Воспаление шейки матки при впч лечение
Содержание статьи:
Вирус папилломы человека (ВПЧ, папилломавирусная инфекция, ПВИ) – причина наиболее часто встречающихся патологических изменений со стороны органов урогенитального тракта, в том числе, и образования папилломы шейки матки.
Чем опасна папиллома шейки матки, и обязательно будет рак шейки матки при ВПЧ – это наиболее частые вопросы женщин с подтвержденной папилломавирусной инфекцией к врачу гинекологу.
Постараемся подробно разобраться, что такое ВПЧ, в чем опасность папилломы шейки матки, особенно при беременности, какие существуют прививки (вакцины) от ВПЧ и какие анализы необходимо сдать при данной патологии.
Вирус папилломы человека
ВПЧ – безоболочный ДНК – содержащий вирус из семейства паповавирусов. Вирусные патогены человека подразделяют на 5 групп.
Вирусы из альфа-групп способны к внедрению в эпителий шейки матки с последующим развитием предрака или рака.
Бетта, гамма и др. персистируют в клетках кожи.
Размер генома – 8000 нуклеотидных пар.
ВПЧ не имеет липопротеиновой оболочки, что обуславливает стабильность и устойчивость к неблагоприятным факторам воздействия.
У вируса нет специфической группы риска или к группе риска можно отнести всех людей, ведущих половую жизнь.
Согласно данным, представленным Всемирной организацией здравоохранения, у 75% женщин репродуктивного возраста хотя бы один раз в жизни был эпизод инфицирования ВПЧ. Такая распространенность вируса обуславливается социальными, экономическими, гигиеническими, поведенческими факторами.
В России положительные результаты при обследовании на ВПЧ выявляются у 45% женщин, при этом, помимо папилломавирусной инфекции, обнаруживаются иные инфекции, передающиеся половым путем.
Особенность ВПЧ в том, что после попадания в организм вирус может длительное время персистировать (находиться в состоянии покоя), но как только произойдет сбой в работе иммунной системы, вирусные патогены начинают активно размножаться, и именно тогда появляются симптомы папилломавирусной инфекции.
Вирусный патоген способен “обманывать” иммунную систему за счет своих свойств:
• отсутствие виремии,
• ограничение репликационного цикла эпителием,
• отсутствие цитолиза,
• локальное иммуноподавляющее (иммуносупрессивное) действие специфических белков вируса.
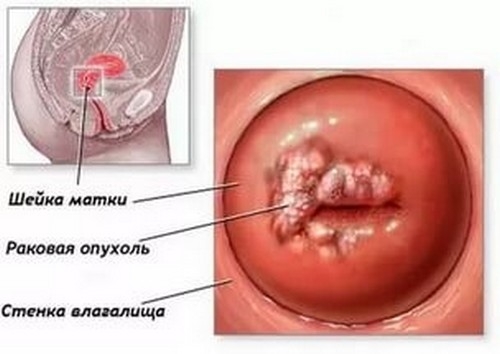
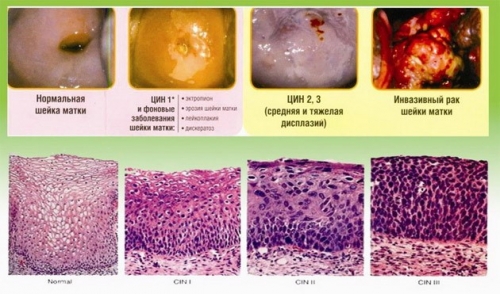
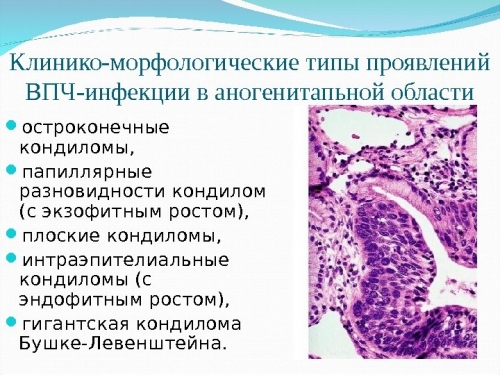
Папиллома шейки матки, вызванная ВПЧ, опасна тем, что может стать причиной развития рака шейки матки и аногенитального рака.
Необходимо отметить, что способность ВПЧ приводить к развитию раковой патологии, очень вариабельна.
Таблица папилломавирусов разных типов

По онкогенному потенциалу условно папилломавирусы разделили на 3 группы:
• неспособные ни при каких условиях привести к опухолевой патологии – неонкогенные
• в определенных обстоятельствах возможно развитие рака – вирусы-онкогены низкого риска.
• в определенных условиях приводят к озлокачествлению, являются подтвержденной причиной рака шейки матки – онкогенные.
Симптомы ВПЧ
Клинические проявления папилломавирусной инфекции находятся в прямой зависимости от состояния иммунитета и типа вируса.
Симптомы заболевания могут быть транзиторными (проходящими), латентными (скрытыми) или персистирующими (периодически повторяющимися).
Около 80% пациентов с ВПЧ сталкиваются с транзиторным типом инфекции, это самый благоприятный вариант, при котором вирус выводится из организма без лечения.
Урогенитальная папилломавирусная инфекция проявляется полиморфными изменениями на коже и слизистых оболочках половых органов.
При поражении шейки матки ВПЧ развиваются очаги поражения, которые сопровождаются ощущением зуда, выделениями, дискомфортом во время полового акта, иногда – кровянистыми выделениями при травматизации сосудов. Данное утверждение больше подходит для клинической и субклинической формы инфекции.
Самостоятельно женщина вряд ли сможет увидеть папиллому шейки матки, потому что образование находится глубоко во влагалище и визуализируется при гинекологическом осмотре на кресле.
Для латентного течения характерно отсутствие жалоб, клинических и морфологических проявлений. В этом случае показано наблюдение в динамике за состоянием шейки матки, влагалища и вульвы.
Диагностика: какие обследования нужны при папилломавирусной инфекции
Осмотр на гинекологическом кресле
Если при осмотре у женщины визуализируется эрозия шейки матки, то обосновано будет проведение диагностики на ВПЧ, так как причиной образования эктопического дефекта может быть папилломавирусное инфицирование.
Инструментальная диагностика
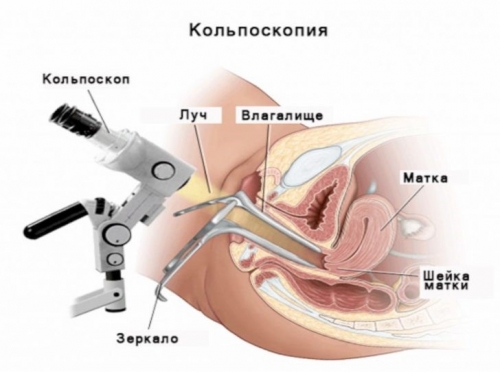
• Расширенная кольпоскопия.
• Жидкостная кольпоскопия.
Тесты с уксусной кислотой и раствором Люголя позволяет диагностировать проявления папиломмавирусной инфекции.
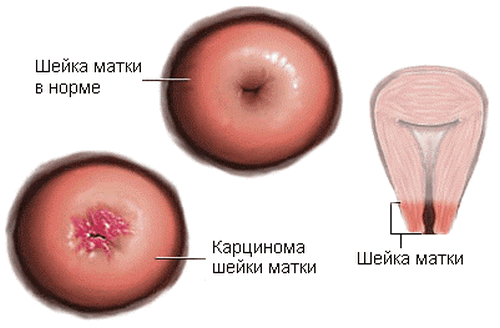
После обработки обращают внимание на присутствие следующих признаков:
• ацетобельный эпителий,
• мозаичность,
• пунктация,
• наличие атипичного очага.
Папиллома на шейке матки, после обработки раствором Люголя, приобретает налет, похожий на “манную крупу”.
• Цитологическое подтверждение.
Характерный признак – обнаружение клеток с койлоцитозом и дискератозом. В этом случае, можно предположить развитие малигнизации CIN (рак на месте).
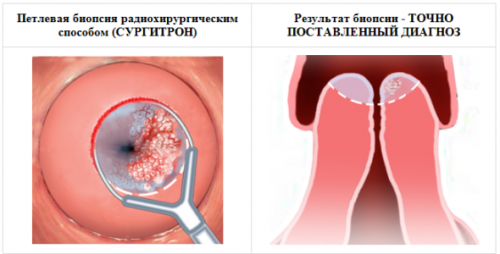
• Биопсия при папилломе шейки матки.
Проведение биопсии шейки матки и выскабливания слизистой цервикального канала с последующей гистологией обосновано в следующих случаях:
1. после получения атипических клеток при цитологическом анализе,
2. при явных признаках инфицирования ВПЧ,
3. при кольпоскопии (онкогенность вируса здесь в расчет не берется),
4. при незначительных изменениях на шейке матки, но при имеющихся подтвержденных лабораторно данных о присутствии высокоонкогенных типов ВПЧ.
• Гистология.

Гистологически папилломавирусная инфекция проявится (по мере утяжеления проявлений) следующим образом:
• кондиломами с дискератозом и акантозом,
• СIN различной степени,
• злокачественной опухолью шейки матки.
Лабораторная диагностика
Как и при любой другой инфекции, при ВПЧ необходимо сдать анализы.
1. Определение вирусной нагрузки.
Для подтверждения ВПЧ обосновано использование Метод Hybride Capture(ВПЧ-Digene-тест), ПЦР-real time для количественной оценки риска озлокачествления.
Чем выше вирусная нагрузка при папилломе шейки матки – тем больше опасность развития рака.
Как расшифровать анализы на ВПЧ
При показателях выше 5 000 геномов риск для озлокачествления папилломы шейки матки очень велик.
Кроме ПЦР-диагностики на ВПЧ, необходимо обследоваться на ИППП для выявления сопутствующих инфекций.
2. ПЦР-анализ на присутствие ВПЧ в организме.
3. Онкомаркеры: p16 ki 67 mcm2 mcm7 Hsp27 и др.
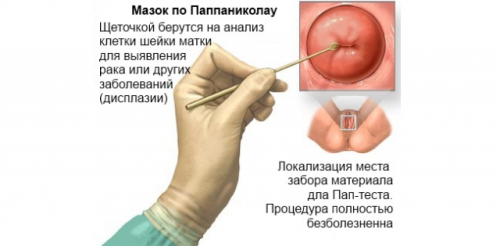
4. В диагностике атипичных состояний шейки матки выполняют мазок по Паппаниколау с последующей онкоцитологией.
Лечение ВПЧ
Выбор тактики лечения всегда определяется индивидуально и зависит от ряда факторов:
• состояния иммунной системы,
• характера и локализации патологических очагов,
• наличия сопутствующих заболеваний,
• степени онкогенности вируса.
Половой партнер должен быть обследован в обязательном порядке. В период прохождения терапии рекомендован половой покой, а после окончания – использование презерватива.
Единой схемы лечения ВПЧ не существует.
Как избавиться от папилломы шейки матки
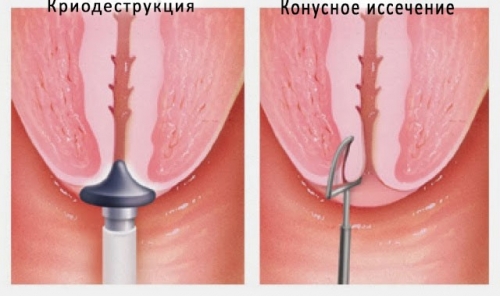
Удаление папилломы на шейке матки возможно с помощью нескольких способов:
• Деструкция (разрушение) жидким азотом, электротоком, лазером, радиоволнами, фотодинамическим и аргоноплазменным воздействием.
• Удаление с помощью цитотоксических препаратов.
Подофиллин, 5- фторурацил.
• Химическое разрушение.
Обработка 3-хлоруксусной кислотой, солкодермом и пр.
Деструктивные методы воздействия считаются более эффективными, но при их применении нарушается анатомо-функциональная целостность (могут быть у нерожавших женщин проблемы во время родов).
На фоне прочих инфекционно-воспалительных заболеваний урогенитального тракта и другой сопутствующей патологии нарушается работа иммунной системы, поэтому показано применение иммуномодулирующих препаратов и противовирусных средств.
Иммуномодуляторы и противовирусные лекарства при ВПЧ назначают как в качестве монотерапии, так и в комплексном лечении.
Наиболее широко применяют следующие средства:

• Гроприносин,
• Панавир,
• Галавит,
• Виферон,
• Изопринозин.
• Промисан.
• Индинол
Изопринзин более современный и эффективный препарат, входит в стандарты терапии стран Европы.
Изоприназин принимают по 2 таб. (1000 мг) 3 раза в день, курсом 5 дней. Необходимо провести 3 курса с перерывами в 4 недели.
Способ применения: Изоприназин назначают после деструктивных вмешательств по 2 таблетки 3 раза в день, в течение 10 дней, повторно проводят еще 2 курса с интервалами в 10- 14 дней.

Панавир – лекарственный препарат на растительной основе, имеет иммуномодулирующее, противовирусное действие.
Способ применения: 0,004% раствор (3 инъекции через 48 часов, далее 2 инъекции через 72 часа, всего 5 инъекций).
Трансректально используют свечи Панавир по 1 свече на ночь, в течение 10 дней.
В виде геля Панавир применяют 2-3 раза в день для местного лечения после оперативного вмешательства.
Во время беременности и грудном вскармливании лекарства не используют.
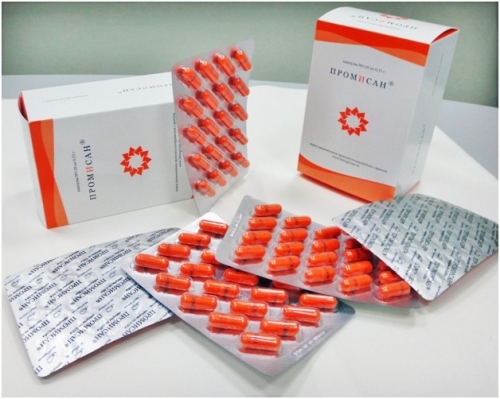
Промисан – онкопротектор, по мнению исследователей, снижает риск развития рака шейки матки в терапии женщин, инфицированных ВПЧ.
Способ применения: по 2 капсулы 2 раза в день в течение полугода.
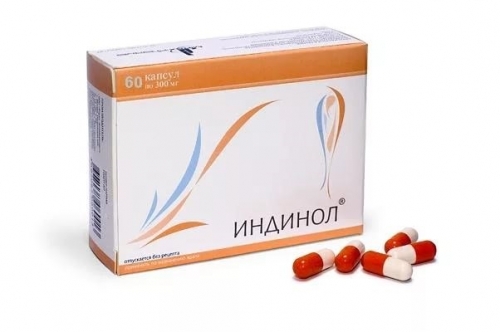
Индинол при ВПЧ способствует избирательной гибели инфицированных клеток, препятствует дальнейшему размножению вируса.
Способ применения: 2 капсулы 2 раза в день от 3 до 6 месяцев.

Галавит – иммуномодулирующий, противовоспалительный и антиоксидантный препарат.
Способствует улучшению всех звеньев иммунитета за счет активации фагоцитоза.
Способ применения:100 мг 1 раз в сутки внутримышечно в течение 5 дней, далее по 100 мг через день до 10-15 инъекций на весь курс.
Выпускается Галавит и в форме суппозиториев.
ВПЧ и беременность

У вируса папилломы человека есть особенность – во время беременности выходить из персистирующего состояния в клинические формы.
Опасность папилломы шейки матки при беременности состоит в возможном инфицировании вирусом гортани ребенка, патогенным воздействием на трофобласт, что вызовет самопроизвольный аборт.
Все препараты с деструктивным действием (подофиллин, подофиллотоксин и.т. д.) обладают повреждающим действием на плод, что является прямым противопоказанием к применению.
Если имеются выраженные наросты, то возможно выполнить лечение лазером или током, но только в 3 триместре.
Иногда, чтобы выключить момент прохождения плода по инфицированным родовым путям, прибегают к кесареву сечению.
Профилактические мероприятия ВПЧ
В качестве первичной профилактики ВПЧ используется вакцинация.
Существует 2 вакцины от папилломавирусной инфекции: Гардасил (квадривалентная, на 4 патогена) и Церварикс (бивалентная, на 2 патогена).
Гардасил – специально разработанная вакцина от папилломы шейки матки.
По мнению изобретателей прививки от ВПЧ, вакцинацию необходимо провести до начала половой жизни.
Рекомендуемый возраст для мальчиков и девочек от 9 до 17 лет, для женщин от 18 до 26 лет.
Прививка против ВПЧ происходит путем трехкратного введения вакцины в течение 6 месяцев. Отметим, что согласно аннотации, вакцина является профилактическим, а не лечебным средством.
Во время вакцинации необходимо предохраняться от беременности.
И Гардасил, и Церварикс официально применяют в 65 странах мира, включая Российскую Федерацию. В США, Франции, Германии вакцины от ВПЧ включены в календарь прививок.
Церварикс и Гардасил от папилломы и рака шейки матки помогают лишь профилактически, но никак не влияют на уже существующую папиллому шейки матки и не лечат папилломавирусную инфекцию.
Автор
Врач-уролог Виктория Мишина
Дата публикации
30.05.2017
Источник
В статье рассмотрены проблема воспалительных заболеваний шейки матки, ассоциированных с папилломавирусной инфекцией, роль эктопии эпителия, приведены показания к консервативному и хирургическому лечению осложненной эктопии. Даны рекомендации по ведению женщин различных возрастных групп.
Введение
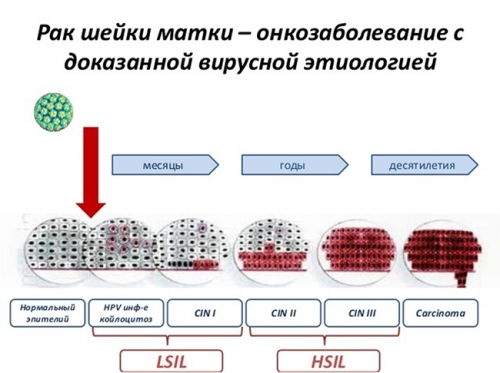
Интерес к папилломавирусной инфекции (ПВИ) не ослабевает с 1983 г., когда немецкий ученый Гарольд цур Хаузен (Harald zur Hausen) впервые обнаружил ДНК вируса папилломы человека (ВПЧ) в биоптатах тканей шейки матки (ШМ), пораженных раком, и это событие стало отправной точкой в истории изучения онкогенности ВПЧ. Годом позже он клонировал ДНК ВПЧ 16 и 18 типов из биоптатов, взятых у пациенток, больных раком ШМ (РШМ) и сегодня, по данным ВОЗ, эти типы вируса обнаруживаются примерно в 70% случаев РШМ.
ПВИ — одна из наиболее часто встречающихся инфекций, передающихся половым путем (ИППП). Наиболее подвержены инфицированию женщины возрастной группы 18–30 лет [1]. Высокая контагиозность инфекции обеспечивает в 80% случаев передачу даже при однократном половом контакте. В большинстве случаев инфекция имеет транзиторный характер, и вирус спонтанно элиминируется в последующие 12–24 мес. [2], но у 10–20% женщин персистирующая инфекция увеличивает риск развития цервикальной эпителиальной неоплазии высокой степени тяжести (НSIL), которая в 30–40% случаев прогрессирует до стадии инвазивного рака [3, 4]. ВПЧ группы высокого онкогенного риска находят у 99,7% женщин с гистологически подтвержденным диагнозом РШМ, что составляет, по данным ВОЗ, более 500 000 женщин в год.
Большинство случаев РШМ возникают в так называемой зоне трансформации, которая представляет собой соединение между проксимальным однослойным железистым эпителием и дистальным многослойным плоским эпителием. На сегодняшний день известно, что в инфицированной клетке вирус может существовать в двух формах: эписомальной (продуктивной) и интегративной (трансформирующей). В первом случае ДНК вируса находится в ядре клетки хозяина в виде стабильной обособленной эписомы (молекулы ДНК, «молчащие» генетические элементы, способные к самостоятельному размножению в цитоплазме). Эта форма считается доброкачественной, поскольку не вызывает патологических изменений в клетках и имеет высокую вероятность спонтанной регрессии. При интегративной форме вирусная ДНК встраивается в геном клетки хозяина и происходит репликация уже измененного генома. Клетка интегрированной вирусной ДНК начинает активно синтезировать вирусные онкобелки Е6 и Е7, быстро выходит из-под иммунного контроля организма и, избегая апоптоза, со временем может перейти в злокачественное состояние. Эписомальная форма ПВИ гистологически характеризуется как дисплазия легкой степени, СIN 1–2 (LSIL), интегративная — как средняя или тяжелая дисплазия, СIN 3 (HSIL) [5].
Эктопия эпителия шейки матки как зона риска реализации онкогенной активности ПВИ
В период полового созревания происходит физиологическая плоскоклеточная метаплазия, в результате которой железистый цилиндрический эпителий (ЦЭ) постепенно превращается в плоский. Клетки, представляющие эту трансформацию, называются метапластическими клетками. Tермин «эктопия» относится к состоянию, при котором на эктоцервиксе присутствует и визуализируется одновременно цилиндрический и метапластический эпителий. Со временем эта переходная зона перемещается в более проксимальное положение. Таким образом, подростки и молодые женщины имеют большую площадь эктопии по сравнению с женщинами более позднего репродуктивного возраста. Тем не менее сроки этого перемещения могут значительно варьировать в зависимости от эндокринного статуса, приема оральных контрацептивов, наличия сопутствующих заболеваний, хронических воспалительных процессов, промискуитета и эпигенетических факторов [6]. Область эктопии — зона с тонким однослойным, хорошо васкуляризированным эпителием, где кровеносные сосуды находятся в тесном контакте с вагинальной средой. Это создает легкий доступ к кровеносной и лимфатической системе, возможно, уменьшая барьеры слизистой оболочки для ИППП. Среди женщин с эктопией ЦЭ ШМ достоверно чаще диагностируются экзо- и эндоцервициты. Хронический цервицит диагностируют у 80% женщин с эктопией ЦЭ ШМ. Частота воспалительной болезни ШМ (N72, МКБ-10) у женщин с эктопией составляет 50–80% [7, 8].
Еще в ХIХ в. немецкий паталогоанатом Рудольф Вирхов обратил внимание на тот факт, что появлению злокачественной опухоли часто предшествует хроническое воспаление в той или иной ткани. Исследования последних десятилетий не только подтвердили это наблюдение, но и выявили целый ряд иммунокомпетентных клеток и специфических факторов, способных как подавлять рост опухоли, так и стимулировать его за счет перепрограммирования иммунных клеток на фоне длительно протекающего воспалительного процесса [9, 10]. Таким образом, эктопированный эпителий ШМ является потенциальной зоной риска для реализации онкогенной активности ПВИ. Значит ли это, что наличие ПВИ на фоне эктопии всегда приводит к диспластическим изменениям ШМ и требует активной лечебной тактики в отношении таких пациенток?
Распространенность эктопии среди женщин репродуктивного возраста в среднем составляет 40% и наиболее часто встречается в возрастной группе до 30 лет [7, 11, 12]. Основными жалобами при эктопии и эктропионе ШМ могут быть обильные вагинальные выделения (лейкорея), боли в области малого таза, посткоитальные кровотечения. Но эктопия ЦЭ и эктропион ШМ могут протекать и абсолютно бессимптомно.
Отмечено, что продуктивная ПВИ возникает в базальных клетках метапластического эпителия зоны трансформации и примыкающего к ней эктоцервикса. Для трансформирующей же формы уязвимым местом являются переходная зона и зона стыка между многослойным плоским эпителием и однослойным ЦЭ ШМ. Есть данные, что повышенная предрасположенность этой области к предраку и РШМ связана с максимальной локализацией там резервных клеток, имеющих высокий потенциал последующей опухолевой трансформации при инфицировании высокоонкогенным ВПЧ [13]. Эктопия также делает эпителий более чувствительным к ИППП, например вызываемым Chlamydia trachomatis и Neisseria gonorrhoeae, на фоне которых ПВИ может протекать более злокачественно [6, 14]. Отмечены более обширная зона эктопированного эпителия и высокий инфекционный индекс на фоне хламидийной инфекции даже при бессимптомном течении эктопии [15, 16]. Таким образом, в план ведения женщин с эктопией ЦЭ ШМ необходимо включать обследование на ИППП даже при отсутствии жалоб у пациентки.
Частота интраэпителиальных поражений ШМ у женщин с эктопией ЦЭ составляет, по разным данным, от 17 до 40%, при этом в возрасте до 23 лет чаще встречается дисплазия легкой степени (CIN 1), а большинство случаев средней и тяжелой дисплазии (CIN 2–3) приходятся на возраст от 25 до 35 лет [7, 12, 17]. Отмечена более высокая распространенность ВПЧ при эктопии, а также частота CIN на фоне ПВИ [18]. В исследовании, проведенном среди девушек-студенток в возрасте до 30 лет, выяснили, что воспалительный тип мазка являлся ведущим в структуре цитологических заключений в группе с эктопией ШМ независимо от наличия ВПЧ. Однако частота CIN была достоверно выше (43,6%) на фоне ПВИ, чем у ВПЧ-негативных пациенток (17,5%) [17].
Особую озабоченность вызывают подростки, т. к. они обычно имеют обширную область эктопии [19]. Интересные данные были получены в когортном исследовании ВИЧ-инфицированных подростков 12–20 лет в 13 городах США. Количество половых партнеров было самым сильным предиктором зрелости ШМ. С увеличением зоны эктопии было связано использование оральных контрацептивов, считается, что эта связь обусловлена влиянием эстрогенов на ЦЭ [19]. Эти результаты подтверждают результаты более раннего исследования, показавшего, что девочки-подростки, начавшие половые отношения, имели более зрелые шейки матки, чем девственницы того же возраста [20].
В одном из российских исследований показано, что высокая активность ВПЧ, превышающая клинически значимые цифры по результатам Digene-теста и сопровождающаяся экспрессией онкобелка Е7, является основным инфекционным фактором, препятствующим нормальному течению физиологической эктопии шейки матки [21]. В работе Л.И. Мальцевой и соавт. выявлена корреляция между низкими показателями соотношения метаболитов эстрогена, позитивной реакцией р16ink4α и наличием длительно персистирующей ПВИ. Было показано, что оценка экспрессии белка р16ink4α и степени нарушения метаболитов эстрогена 2-ОНЕ1/16α-ОНЕ1 позволяет дифференцированно подходить к лечению ВПЧ-ассоциированных цервицитов [22].
Выбор тактики ведения пациенток
Несмотря на то, что эктопия является нормальным физиологическим процессом и не нуждается в лечении, существует несколько аргументов в пользу лечения этого состояния. Наиболее известным является тот факт, что хронический цервицит (ХЦ) на фоне эктопии ЦЭ служит мощным кофактором для персистенции ВПЧ и возникновения интраэпителиальных поражений [14]. Как уже упоминалось ранее, существует взаимосвязь между плоскоклеточной метаплазией и индукцией плоскоклеточного РШМ и клетки, подвергающиеся метаплазии, более восприимчивы к канцерогенам. Теоретически, если, удаляя эктопию, процесс эпителизации возможно ускорить и уменьшить размер метаплазии, это создает неблагоприятные условия для персистенции ВПЧ и снижает риск развития интраэпителиальных поражений, а значит, и РШМ [23, 24].
Постоянные обильные выделения (лейкорея), болевые ощущения и посткоитальные кровотечения вызывают значительный дискомфорт у женщин и могут быть показанием к лечению эктопии ЦЭ ШМ. В исследовании Y. Çekmez et al., посвященном влиянию криотерапии на симптомы эктопии, показатели успеха были в 9 раз ниже у женщин, имевших 3 и более эпизода цервицита за 6 мес. У 91,9% пациенток с эктопией ЦЭ была отмечена выраженная лейкорея. Показатель успешности в отношении этого симптома был удовлетворительным (89,5%), так же как и в отношении посткоитальных кровотечений (81,8%) и рецидивов ХЦ (80%). Наименее благоприятный результат достигнут в отношении болевого синдрома (58%). Эпителизация достигнута в 95,9% случаев. Авторы работы делают вывод, что не стоит откладывать проведение криотерапии у пациенток с ХЦ при отсутствии стойкого эффекта от консервативной терапии [25].
В Клинических рекомендациях по профилактике РШМ Минздрава России 2017 г. активное ведение женщин с CIN 1 рекомендуется в следующих случаях: неудовлетворительные данные кольпоскопии, обширные поражения, длительность течения CIN 1 более 18 мес., возраст старше 35 лет, невозможность дальнейшего наблюдения (нежелание женщины посещать врача).
У молодых женщин с LSIL (CIN 1, CIN 2, p-16-негативные), доказанными в биоптате, и удовлетворительным результатом кольпоскопии предпочтительно применение иммуномодулирующих препаратов с проведением цитологического исследования через 6, 12, 24 мес. В случае прогрессии через 12 мес. показано деструктивное или эксцизионное лечение. Выжидательная тактика ведения с цитологическим контролем и кольпоскопией при CIN 2 и 3 приемлема для беременных женщин и очень молодых пациенток с CIN [26].
Использование препаратов глицирризиновой кислоты в лечении заболеваний, ассоциированных с вирусными инфекциями
В последние годы было проведено много исследований относительно ингибирующего воздействия природных материалов на рак. Поиск соединений, нетоксичных для человека и не имеющих побочных эффектов, привлекает внимание многих исследователей. Так, установлено, что соединения, полученные из корня солодки, такие как глицирризин, обладают противовоспалительной активностью, а 18-β-глицирризиновая кислота (ГК), которая представляет собой тритерпеноидное соединение, полученное в результате гидролиза глицирризина, обладает не только противовоспалительным, но и противоопухолевым действием [27]. ГК также увеличивает производство вирусного циклина, который вызывает избирательную гибель зараженных вирусом клеток, и стимулирует выработку интерлейкина-12 в макрофагах, что облегчает развитие Т-хелперных лимфоцитов при клеточноопосредованном иммунном ответе, ингибирует фосфорилирование вирусного белка, опосредованное клеточными киназами, и модифицирует посттрансляционные сигналы [28]. Благодаря этим свойствам ГК нашла широкое применение при лечении заболеваний, ассоциированных с вирусными инфекциями, в т. ч. ПВИ.
Ряд российских и зарубежных исследований показали эффективность препаратов на основе ГК при лечении патологии ШМ на фоне ПВИ как в сочетании с деструктивными методами, так и в виде монотерапии.
Так, в исследовании C.Е. Вагановой на фоне применения спрея на основе ГК (Эпиген Интим) сроки эпителизации ШМ после криохирургического лечения сокращались в 1,4 раза (в среднем на 12 дней) [29]. В двух других исследованиях получено двукратное снижение количества рецидивов ПВИ на фоне изолированного лечения препаратом локального действия (Эпиген Интим) на основе ГК на доклинической стадии ВПЧ-инфекции и достоверное повышение частоты излечений дисплазии при сочетании криовоздействия и последующей местной терапии ГК [30].
В исследовании, где 40% ВПЧ-инфицированных пациенток исходно имели LSIL (CIN 1 и 2) в цитологических мазках, через 12 нед. комбинированного применения препарата ГК (перорально и интравагинально) регресс клинических проявлений ПВИ по результатам кольпоскопии и ПАП-теста наблюдался у большинства пациенток (74%) (P<0,001). Тем не менее у 27,7% пациенток из общей группы сохранялся LSIL, и только у одной цервикальная интраэпителиальная неоплазия прогрессировала от CIN 1 до CIN 2. Однако исследователи сделали вывод, что при интраэпителиальных поражениях могут потребоваться более длительное лечение и мониторинг в течение года [31]. Также более высокая эффективность препарата ГК в сочетании с иммуномодулятором показана в отношении аногенитальных бородавок в сравнении с подофиллином [31].
Опыт применения ГК у молодых женщин с персистирующей в течение года ПВИ показал снижение числа пациенток с клиническими проявлениями ХЦ в 2 раза, улучшение показателей ПАП-теста до нормы у 29% женщин, снижение количества атипических изменений при кольпоскопии с 40 до 16%. Элиминация ВПЧ в течение 6 мес. в группе лечения составила 40%, в контрольной группе без лечения — 29% [17].
Таким образом, препараты на основе ГК, обладающей противовоспалительным, иммуностимулирующим, регенерирующим действием, являются оптимальным выбором при лечении ВПЧ-ассоциированных цервицитов у молодых женщин, способствуют более быстрой регенерации слизистой ШМ после деструктивного лечения и могут быть рекомендованы для длительного применения, в т. ч. у беременных женщин с признаками интраэпителиального поражения ШМ.
Заключение
Эктопия ЦЭ ШМ является функциональным состоянием и не требует специального лечения. Более того, грубое вмешательство в процесс метаплазии может приводить к нежелательным акушерским осложнениям. Однако нежный ЦЭ является уязвимой зоной и комфортной питательной средой для трансмиссивных бактериальных и вирусных инфекций, что способствует развитию ХЦ и препятствует нормальной эпителизации ШМ. В случае присоединения ПВИ высока вероятность развития интраэпителиальных поражений. Тем не менее в целом прогноз этого состояния благоприятный. ВПЧ-инфицированные пациентки с эктопией ЦЭ ШМ требуют дифференцированного подхода к ведению в зависимости от возраста, анамнеза и клинических проявлений. Молодым женщинам в возрасте до 25 лет, как правило, достаточно консервативного лечения и динамического наблюдения с цитологическим контролем. Возрастная группа 25–35 лет требует активной тактики при трансформирующей форме ПВИ: цитологических изменениях среднетяжелой степени в сочетании с высокой вирусной нагрузкой и/или продукцией онкобелков. В возрастной группе старше 35 лет физиологическая эктопия ЦЭ ШМ встречается редко. Тактика определяется согласно общеклиническим рекомендациям по ведению женщин с интраэпителиальными поражениями ШМ. Важным моментом является идентификация и модификация кофакторов, потому что они могут оказать существенное влияние на модулирование персистирующей инфекции и прогрессирование ПВИ до неоплазии.
Сведения об авторах:
1Шаргородская Анна Витальевна — к.м.н., врач акушер-гинеколог, ORCID iD 0000-0002-8982-0501;
1,2Бебнева Тамара Николаевна — к.м.н., врач акушер-гинеколог, доцент кафедры акушерства и гинекологии. ORCID iD 0000-0001-9524-8962.
1ФГБУ «НМИЦ эндокринологии» Минздрава России. 117036, Россия, г. Москва, ул. Дмитрия Ульянова, д. 11.
2ФГАОУ ВО РУДН. 117198, Россия г. Москва, ул. Миклухо-Маклая, д. 6.
Контактная информация: Шаргородская Анна Витальевна, e-mail: anna.shargo@gmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 12.03.2019.
About the authors:
1Anna V. Shargorodskaya — MD, PhD. ORCID iD 0000-0002-8982-0501;
1,2Tamara N. Bebneva — MD, PhD, associate professor of the Department of Obstetrics and Gynecology. ORCID iD 0000-0001-9524-8962.
1National Medical Research Center of Endocrinology. 11, Dmitriy Ul’yanov str., Moscow, 117036, Russian Federation.
2Russian University of Peoples’ Friendship. 6, Miklukho-Maklaya str., Moscow, 117198, Russian Federation.
Contact information: Anna V. Shargorodskaya, e-mail: anna.shargo@gmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 12.03.2019.
Источник
