Таргетная терапия меланомы braf

Онкологическая клиника в Москве ¦ ЛЕЧЕНИЕ МЕЛАНОМЫ В ЕВРОПЕЙСКОЙ КЛИНИКЕ ¦ Таргетная терапия меланомы
Одним из последних достижений в области борьбы со злокачественной онкопатологией стала таргетная терапия. Это принципиально новый подход к лечению опухолей, который успешно применяется онкологами при меланоме, в т.ч. и при запущенных ее стадиях.
.jpg) Неотъемлемым условием назначения таких уникальных медпрепаратов, как дабрафениб (Dabrafenib), вемурафениб (Vemurafenib), траметиниб (Trametinib) и др. является положительный результат процедуры генетического тестирования меланомной опухоли на предмет наличия мутаций V600E либо V600K в гене BRAF, которые, согласно официальной статистике, обнаруживаются у 40-70% больных с данным диагнозом.
Неотъемлемым условием назначения таких уникальных медпрепаратов, как дабрафениб (Dabrafenib), вемурафениб (Vemurafenib), траметиниб (Trametinib) и др. является положительный результат процедуры генетического тестирования меланомной опухоли на предмет наличия мутаций V600E либо V600K в гене BRAF, которые, согласно официальной статистике, обнаруживаются у 40-70% больных с данным диагнозом.
Эти лекарственные средства, именуемые ингибиторами BRAF, обеспечивают целевое, избирательное уничтожение аномально активных протеинов клеток, не причиняя вреда здоровым клеточным структурам. Благодаря этому уменьшаются размеры новообразования, облегчаются симптомы заболевания, продлевается и улучшается качество жизни пациентов.
Таргетные препараты в зависимости от нюансов конкретной клинической ситуации назначаются докторами в виде монотерапии либо комплексно. Так, к примеру, благодаря комбинации траметиниба и дабрафениба удается заметно уменьшить сроки уничтожения меланомы и сократить некоторые побочные эффекты, негативно отражающиеся на кожных покровах.
Кроме того, эксперты изучают указанную комбинацию таргетных препаратов относительно ее способности предотвратить BRAF-мутирование рецидивной меланомы после оперативного лечения у больных из группы повышенного риска, обусловленного вовлечением в онкопроцесс лимфоузлов.
Также учеными исследуется безопасность комбинации траметиниба и дабрафениба в случае необходимости применения этих средств на протяжении длительного периода времени.
Помимо таргетных препаратов, оказывающих влияние на протоонкоген BRAF, существуют медикаменты, целенаправленно воздействующие на мутацию гена C-KIT.
 Этот протоонкоген выявляется примерно в 1/3 всех случаев заболевания меланомой с локализацией первичной опухоли на коже ладоней и ступней (акральная меланома), а также слизистых оболочек.
Этот протоонкоген выявляется примерно в 1/3 всех случаев заболевания меланомой с локализацией первичной опухоли на коже ладоней и ступней (акральная меланома), а также слизистых оболочек.
Если говорить о меланомах слизистой, KIT-мутации преимущественно встречаются при аноректальных меланомах и меланомах внешних половых органов (вкл. вагинальную локализацию).
Кроме того, относительно часто протоонкоген C-KIT выделяют при меланомных опухолях придаточных пазух носа (параназальных синусов) и носоглотки. Кстати, обычно мутация KIT не конфликтует и не пересекается с прочими онкогенными мутациями, сопряженными с развитием меланомы (NRAS-мутацией, BRAF-мутацией и т.д.). Для воздействия на эту мутацию доктора-онкологи используют таргетные препараты нилотиниб (Nilotinibum) и иматиниб (Imatinibum).
Первым препаратом таргетной терапии меланомы с мутацией NRAS является ингибитор MEK162, благодаря приему которого практически у 70% больных данной категории удается получить реакцию на лечение и добиться стабилизации заболевания.
Сейчас благодаря разработке инновационных таргетных препаратов имеется возможность терапии меланомных опухолей, лекарственное лечение которых до недавнего времени было малоэффективно.
Следует отметить, что препараты таргетной терапии меланомных опухолей не являются иммунотерапевтическими средствами как таковыми: иммунотерапия предполагает введение различных вакцин, которые способствуют усилению противоопухолевого иммунитета, а таргетная терапия основана на использовании антител к определенной мишени – к мутировавшему гену или его белковому компоненту (протеину), вызывающему рост опухоли.
+7(925)191-50-55 – европейские протоколы лечения в Москве
ЗАПРОС в КЛИНИКУ
Источник

В норме ген BRAF вместе с факторами роста и гормонами участвует в регуляции деления клеток за счет активации специфического сигнального пути. Если же его структура изменяется, то процесс деления выходит из-под контроля. Мутации в гене BRAF выявляются при различных видах рака, однако на первом месте в списке онкологических заболеваний стоит меланома. Определить статус гена при данной болезни крайне важно, так как от этого будет зависеть дальнейшая тактика лечения.
Частота и виды мутаций BRAF
По данным разных авторов, BRAF мутация встречается от 30% до 70% пациентов, которым поставлен диагноз «меланома». При этом изменения в гене могут быть самыми разнообразными. Всего известно более 40 BRAF мутаций, но наиболее часто (около 90% всех случаев) выявляется замена аминокислоты валина на аминокислоту глутамина в кодоне 600. Соответственно, такая мутация называется BRAF V600E. Второе по популярности изменение в гене при меланоме – это замена аминокислоты валина на аминокислоту аспарагин в том же кодоне. Такая мутация обозначается V600K.
Методы диагностики
Выявить мутации BRAF можно при помощи молекулярно-генетических методов диагностики. Для проведения исследования необходим образец тканей меланомы кожи, в которых содержится не менее 20% опухолевых клеток. Как правило, такой материал поступает в лабораторию после удаления, после чего он фиксируется в формалине и заключается в парафиновые блоки. Перед определением мутаций необходимо выполнить пробоподготовку. Материал извлекается из парафина, затем выполняется процесс экстракции ДНК, которая исследуется.
Базовым методом, который позволяет выявить мутации в гене BRAF, является полимеразная цепная реакция (ПЦР). Это исследование является относительно простым и дешевым, обладает хорошей чувствительностью и специфичностью, однако имеет существенный недостаток. Один анализ позволяет определить только одну мутацию BRAF. Если же стоит задача выявить несколько мутаций, то исследование придется повторять.
Более совершенным считается секвенирование, при помощи которого можно установить точную последовательность ДНК целого гена. Данный метод более затратный и требует дорогостоящего оборудования, но при этом он позволяет одновременно выявить все мутации в гене BRAF за одно исследование. Среди недостатков секвенирования можно отметить риск получить ложноотрицательный результат (выявляется в 2%-10% случаев) из-за присутствия в материале большого количества нормальных клеток с неизмененной ДНК.
Зачем определять BRAF мутацию при меланоме
Определение мутации в гене BRAF имеет важное значение при подборе лечения меланомы. Одним из современных методов является таргетная терапия, которая направлена на устранение конкретного механизма образования опухолевых клеток. В случае с меланомой применяются ингибиторы мутированного фрагмента гена BRAF, которые прерывают цепочку биохимических реакций и не дают опухоли развиваться дальше. При назначении таких препаратов определение статуса гена BRAF должно проводиться в обязательном порядке. При отсутствии мутации дорогостоящее лечение окажется неэффективным, а в некоторых случаях может и ускорить прогрессирование опухолевого процесса.
Препараты из группы ингибиторов BRAF могут применяться только при лечении метастатической меланомы. При этом не изучена эффективность лечения в адъювантном режиме, поэтому такие препараты не назначают пациентам, у которых выполнялось хирургическое удаление опухоли или метастазов, а также химио- и лучевая терапия.
Первыми зарегистрированными препаратами из группы ингибиторов BRAF, которые начали применяться при лечении метастатической и неоперабельной меланомы, стали вемурафениб и дабрафениб. При проведении клинических испытаний, они показали очень хорошие результаты. В настоящее время применяется комбинированное лечение меланомы, при котором, кроме ингибиторов BRAF назначаются ингибиторы МЕК. Такое сочетание позволяет максимально замедлить прогрессирование заболевания и увеличить продолжительность жизни пациентов.
Несмотря на большие успехи в лечении меланомы, все еще остаются нерешенными несколько проблем. Во-первых, отсутствуют эффективные методы терапии, которые можно применять при отсутствии мутаций в гене BRAF. Во-вторых, при назначении ингибиторов BRAF у пациентов спустя некоторое время развивается устойчивость к такому лечению, и меланома начинает снова прогрессировать.
Источник
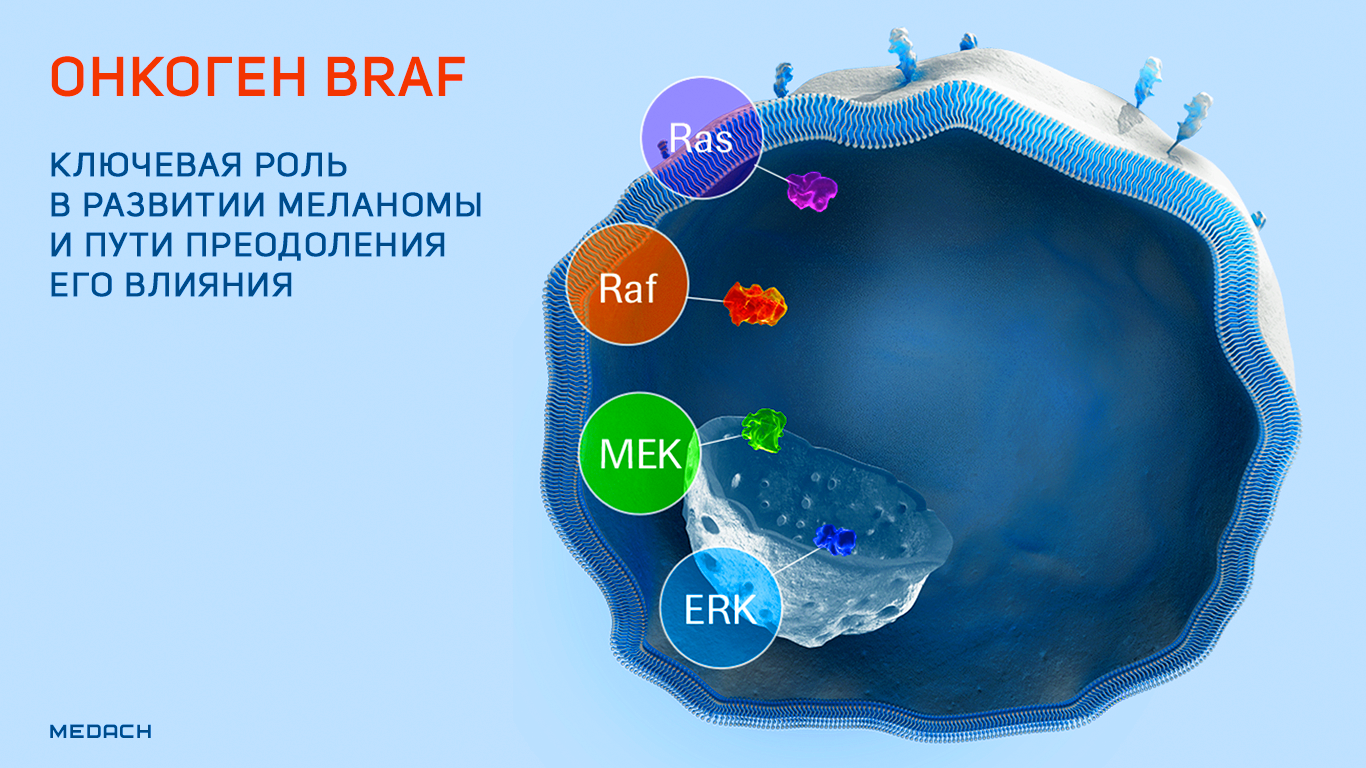
BRAF является достаточно известным онкогеном, а вот приставка V600E после его названия ясна не каждому. Между тем мутация в структуре данного онкогена играет ключевую роль в развитии меланомы — опухоли с одним из самых неблагоприятных прогнозов. В этом материале будут рассмотрены история разработки средств против меланомы с мутацией в гене BRAF и пути преодоления резистентности последнего к современной таргетной терапии.
BRAF представляет собой онкоген, кодирующий белок B-Raf — серин-треонин протеинкиназу, участвующую в функционировании высокоонкогенных сигнальных путей RAS/RAF/MEK/ERK (название одного из перечисленных сигнальных путей и дало имя данному белку и его гену). Продукт BRAF обнаруживается в клетках абсолютно разных типов в неактивном состоянии. Его функциональная активация происходит путем димеризации под действием сигнального пути RAS. Активированный B-Raf фосфорилирует и активирует другие ассоциированные сигнальные пути, и киназный каскад, запускаемый в результате этих процессов, поддерживает выживание клеток и их пролиферацию, одновременно ингибируя дифференцировку [1].
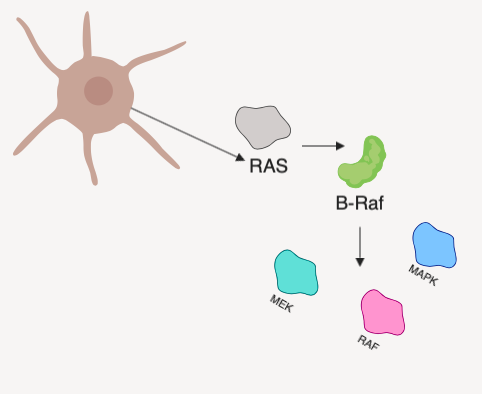
Рисунок 1 | Упрощенная схема активации сигнальных путей, в которых принимает участие протеин B-Raf.
BRAF и его продукт играют критическую роль в формировании опухолей человеческих тканей. Около 7 % всех опухолей связаны с мутацией данного гена, включая 100 % случаев волосатоклеточного лейкоза, 50–60 % случаев меланомы, 30–50 % случаев папиллярной карциномы щитовидной железы, 10–20 % случаев колоректальных опухолей и 3–5 % случаев немелкоклеточного рака легкого. Самой распространенной мутацией является нуклеотидная замена, которая превращает валин в позиции 600 в глутамин (мутация V600E), лизин (мутация V600K) или другую аминокислоту (V600 A/D/G/L и другие). Подобные мутации способствуют тому, что B-Raf перестает зависеть от активации сигнального пути RAS и становится функционально активным в форме мономера [1].
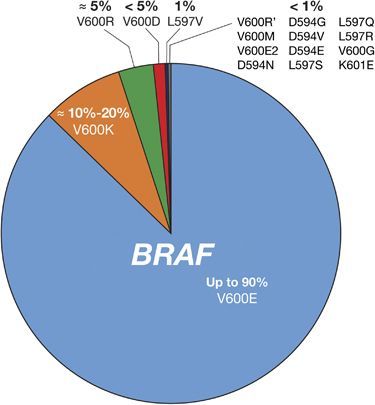
Рисунок 2 | Частота встречаемости наиболее распространенных мутаций BRAF.
Обнаружение активирующих мутаций в данной серин-треонин киназе послужило основой волны последующих исследований того, насколько критическую роль играют ассоциированные с ней сигнальные пути в инициации и прогрессии меланомы и других опухолей. Так, активация ассоциированного с B-Raf сигнального пути МАРК in vivo ассоциируется с пролиферацией клеток меланомы. Доклинические исследования, длившиеся более 15 лет, утвердили, что центральную роль в контроле пролиферации клеток меланомы играет мутация BRAF V600E. Кроме того, данная активирующая мутация оказывает влияние на апоптоз, миграцию, инвазию клеток меланомы, метаболизм глюкозы в них, их адаптацию к гипоксии и ангиогенез формирующейся опухоли. Таким образом, чувствительность опухоли к химиотерапии обретает зависимость не только от функциональной активности B-Raf, но и от скорости протекания в ее клетках процессов, связанных с активацией МАРК [2].
Определение и характеристика мутаций BRAF оказывает существенное влияние на подбор терапии меланомы. Выявление мутаций в структуре этого онкогена осуществляется путем проведения методов генетического секвенирования [3]. Подробнее эти методы рассмотрены в данном материале.
До открытия активирующих мутаций в гене BRAF, меланома крайне тяжело поддавалась терапии. Классическая химиотерапия и пролекарство дакарбазин демонстрировали небольшие терапевтические возможности для клиницистов, стремящихся снизить заболеваемость данным типом опухоли. В 2002 году было обнаружено наличие мутаций BRAF в 60 % случаев меланом, что сыграло огромную роль в определении сущности данного гена в инициации и прогрессировании опухолей кожи. Сегодня известно, что активирующая мутация BRAF обнаруживается в 50 % случаев меланом и в 80 % тканей меланоцитарных невусов. Явная ассоциация данного онкогена с формированием меланоцитарных опухолей дала основу для разработки средств таргетной терапии меланомы, что принесло новую надежду как клиницистам, так и пациентам.
Первый препарат антител, активных против B-Raf, был разработан в 2011 году [4]. Первоначально для таргетной терапии меланомы ингибиторы BRAF (вемурафениб, дабрафениб) использовались как самостоятельные агенты. В дальнейшем была выявлена способность клеток меланомы к формированию резистентности против таких агентов. Одни из наиболее распространенных путей такой фармакорезистентности — это реактивация сигнального пути МАРК, ограничение апоптоза клеток меланомы, а также активация сигнального пути PI3K, стабилизирующего выживаемость меланомных клеток «в обход» МАРК [2, 5].
В настоящее время во избежание формирования терапевтической резистентности при лечении меланомы ингибиторы BRAF комбинируют с ингибиторами другого онкогенного сигнального пути — МЕК (такими препаратами являются биниметиниб и траметиниб). Систематические обзоры и мета-анализы продемонстрировали, что применение подобной комбинации увеличивает общую продолжительность жизни пациентов и замедляет прогрессирование опухоли в сравнении с монотерапией только ингибиторами BRAF [6].
К сожалению, несмотря на обилие современных разработок, меланома по-прежнему ассоциируется с крайне негативным терапевтическим прогнозом и малой общей выживаемостью. Разработки средств таргетной терапии данной опухоли непременно должны продолжаться — возможно, еще одна новая комбинация поможет существенно снизить смертность от этой патологии и сделать диагноз «меланома» менее пугающим.
Источники:
1. The landscape of BRAF transcript and protein variants in human cancer. / Andrea Marranci, Zhijie Jiang, Marianna Vitello [et al]. // Mol Cancer. — 2017. — Vol. 16. — p. 85.
2. Overcoming resistance to BRAF inhibitors. / Imanol Arozarena, Claudia Wellbrock. // Ann Transl Med. — 2017. — Vol. 5, №19. — p. 387.
3. Rapid BRAF mutation tests in patients with advanced melanoma: comparison of immunohistochemistry, droplet digital PCR, and the Idylla mutation platform. / Cornelis Bisschop, Arja ter Elst, Lisette J. Bosman [et al]. // Melanoma Res. — 2018. — Vol. 28, №2. — p. 96-104.
4. BRAF V600E-specific antibody: a review. / Ritterhouse LL, Barletta JA. // Semin Diagn Pathol. — 2015. — Vol. 32, №5. — p. 400-408.
5. BRAF-mutant melanoma: treatment approaches, resistance mechanisms, and diagnostic strategies. / Francesco Spagnolo, Paola Ghiorzo, Laura Orgiano [et al]. // Onco Targets Ther. — 2015. — Vol. 8. — p. 157-168.
6. Combination therapy of BRAF inhibitors for advanced melanoma with BRAF V600 mutation: a systematic review and meta-analysis. / Kim S, Kim HT, Suh HS. // J Dermatol Treat. — 2018. — Vol. 29, №3. — p. 314-321.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник

Выявление различий в мутации гена BRAF с помощью молекулярно-генетических тестов позволяет определить эффективность лечения меланомы. В ходе нового исследования выяснилось, что существуют различия между генотипами мутации меланомы BRAF — V600K и V600E, которые ведут к разным ответам на таргетную терапию и иммунотерапию.
Таргетная терапия при BRAF мутации меланомы V600
Пациенты, которые имеют мутацию меланомы BRAF V600K, меньше поддаются лечению таргетной терапией или ингибиторами BRAF / MEK. В тоже время мутация BRAF V600E позволяет достаточно эффективно лечить меланому в таком случае.
В первой части приняло участие 93 пациента с прогрессирующей меланомой. Пациентам с разными мутациями BRAF проводилось таргетное лечение ингибиторами BRAF / MEK наряду с оценкой уровня эффективности лечения.
Генотипы BRAF — V600K и V600E имеют уникальный молекулярный профиль:
BRAF V600K имеет пониженную экспрессию сигнального пути ERK, большую экспрессию генов P13AKT и значительно большую мутационную нагрузку (количественный показатель, характеризующим число мутаций в 1 мегабазе кодирующего генома опухолевых клеток). Таким образом, он меньшую восприимчивость к подавлению BRAF/MEK.
BRAF V600E обладает более обширной активацией сигнального пути ERK, а также вызывает хороший ответ на подавление BRAF/MEK.
В Израиле можно провести онко-тесты на мутации меланомы и подобрать подходящее персонализированное лечение у лучших онкологов, которые специализируется на злокачественных заболеваниях кожи.
Было отмечено, что при лечении комбинированной терапией с подавлением BRAF / MEK, большинство пациентов в группе с мутацией гена V600K имеют по отношению к группе с V600E:
- низкую частоту ответа на лечение – 31% и 52%
- низкий уровень полного ответа – 0% и 10%.
Пациенты имели следующие показатели выживаемости в подгруппах:
- V600K – медиана выживаемости – 5,7мес ;
- V600E – медиана выживаемости – 7,1мес, при этом около 20% оставались без признаков прогрессирования меланомы через пять лет.
Несмотря на эти численные различия в показателях ответа и выживаемости без прогрессирования, общая выживаемость была одинаковой в обеих группах. Эта часть исследования подтвердила результаты предыдущего исследования, и показывает, что меланома с мутацией V600K имеет более низкий показатель ответа и более короткую выживаемость при лечении таргетной терапией ингибиторами BRAF / MEK.
Иммунотерапия при BRAF мутации меланомы V600
На втором этапе исследования было включено 103 пациента с меланомой, которым проводилась иммунотерапия препаратами пембролизумаб или ниволумаб.
Из этих пациентов исследователи провели неродственную выборку с мутацией меланомы BRAF:
- V600E — 84 пациента;
- V600K – 19 пациентов.
Ответ на иммунотерапию на основе генотипа BRAF коррелировал с клиническими ожиданиями. После медианного периода наблюдения в 31,7 месяца исследователи выявили тенденцию более высокого уровня ответа на иммунотерапию у пациентов с мутациями V600K по сравнению V600E — 53% против 29%. Кроме того, выживаемость без прогрессирования была более длительной у пациентов с подтипом мутации BRAF V600K — 19 против 2,7 месяцев. Тем не менее, общая выживаемость существенно не отличалась — 20,4 против 11,7 месяцев.
Выводы второй части исследования показали, что при мутации меланомы BRAF V600K лучшие результаты показывает иммунотерапия.
Источник: EMED, Израиль
Израильские онкологи активно используют таргетную и иммунотерапию при лечении меланомы. Израиль демонстрирует один из самых лучших показателей в мире по эффективности лечения меланомы.
Источник
Основной метод лечения меланомы на 0, I и II стадиях — хирургический. Прибегают к широкому иссечению — опухоль удаляют, захватывая здоровые ткани вокруг нее и под ней. Количество здоровых тканей, которые следует удалить, определяется размерами новообразования и его локализацией. Например, если меланома находится на лице, важен косметический эффект, поэтому здесь обычно удаляют меньше тканей.

Наш эксперт в этой сфере:
Заместитель главного врача по лечебной работе,
врач-онколог, хирург, к.м.н.
Позвонить врачу
На стадии 0 и IA (если опухоль прорастает в кожу менее чем на 0,8 мм и на ней нет изъязвления) широкое иссечение — единственный метод лечения, в дальнейшем пациент должен находиться под наблюдением.

На стадиях IB и II во время операции проводят сентинель-биопсию. В опухоль вводят радиофармпрепарат или флуоресцентный краситель. Он проникает в лимфатические сосуды и распространяется по ним в лимфатические узлы. Смотрят, в какие узлы препарат попал в первую очередь. Это — дозорные, или сигнальные лимфоузлы. Их удаляют и проводят биопсию. Если в них найдены опухолевые клетки, необходимо удаление регионарных лимфатических узлов. Врач может назначить адъювантную терапию в высоких дозах в течение года.
При III стадии удаляют первичную опухоль и лимфатические узлы. После операции назначают разные варианты адъювантной терапии:
- Иммунопрепараты
- Таргетные препараты
- Лучевая терапия бассейна пораженных лимфатических узлов — для пациентов из группы повышенного риска.
- Биохимиотерапия: сочетание иммунопрепаратов с химиопрепаратами.
Иногда вторичные опухоли находятся рядом с основной, и/или раковые клетки обнаруживаются в лимфатических сосудах, но не в лимфатических узлах. В таких случаях лечебная тактика может быть разной. Если опухоль нерезектабельна (не может быть полностью удалена хирургически),назначают терапию, как при меланоме 4 стадии с метастазами. В других случаях удается полностью удалить опухолевую ткань и добиться негативного края резекции. Есть и другие варианты лечения:
- Лучевая терапия.
- Изолированная гипертермическая перфузия (LIMB) — процедура, во время которой подогретый химиопрепарат вводят в артерию руки или ноги. Лекарство попадает только в определенную часть тела и не проникает в общий кровоток, а за счет более высокой температуры оно эффективнее уничтожает раковые клетки. Иногда такая процедура помогает избежать ампутации конечности.
При меланоме IV стадии проводят паллиативные хирургические вмешательства. Они не избавляют от меланомы, но помогают уменьшить размеры опухоли, справиться с болью и другими симптомами, продлить жизнь пациента.
В паллиативных целях назначают иммунопрепараты, таргетные препараты, химиопрепараты.
Отзывы наших пациентов
Пациентка поступила неделю назад с острым приступом на фоне онкологического заболевания. Ей было проведено экстренное лечение. Пациентка благодарит персонал клиники за спасение жизни.
«Врачи оказали мне помощь, спасли меня от неминуемых катастрофических последствий моего заболевания».читать дальше
Алла Михайловна приехала из Ялты в клинику «Медицина 24/7» для лечения меланомы.
Состояние пациентки при поступлении было неудовлетворительным, было затруднено питание, часто случались приступы тошноты и рвоты. Осуществить должное лечение по месту жительства пациентка не могла из-за отсутствия должной технической базы и необходимых препаратов в клиниках Ялты. На данный момент, в клинике «Медицина 24/7» пациентке был проведён комплекс лечебных…читать дальше
Иммунотерапия при меланоме
В норме иммунная система использует некоторые молекулярные механизмы, чтобы удержать себя от атаки на здоровые ткани, это помогает предотвратить тяжелые аутоиммунные заболевания. Те же молекулярные механизмы могут использовать злокачественные опухоли. Особые молекулы — контрольные точки — подавляют активность иммунных клеток. Снова активировать иммунитет и заставить его атаковать клетки меланомы помогают специальные препараты — ингибиторы контрольных точек. Они были разработаны относительно недавно. Для борьбы с меланомой используют три ингибитора контрольных точек:
- Блокаторы PD-1 — белка, который находится на поверхности T-клеток и подавляет их способность атаковать опухоль.
- Блокатор CTLA-4. CTLA-4 — это еще один белок на поверхности T-клеток, который подавляет их активность.
Доказано, что ингибиторы контрольных точек помогают продлить жизнь пациентов, страдающих меланомой, но нет доказательств того, что лечение ими способно привести к ремиссии.
Другие препараты для иммунотерапии меланомы:
- Цитокины — вещества, которые стимулируют иммунную систему. Они помогают уменьшить размеры меланомы у 10–20% пациентов. Иногда эти препараты назначают в сочетании с химиопрепаратами. Для того чтобы препарат эффективно работал, его нужно вводить в больших дозах. Не все пациенты могут получать такое лечение из-за серьезных побочных эффектов.
- Онколитические вирусы заражают и уничтожают злокачественные клетки, а также помогают усилить противоопухолевые иммунные реакции.
- Вакцина БЦЖ стимулирует противоопухолевый иммунитет. Ее, как и онколитический вирус, нужно вводить непосредственно в опухоль. Вакцину БЦЖ обычно применяют при III стадии меланомы.
- Иммуномодулирующее средство — Применяется в форме крема. Его наносят на пораженный опухолью участок кожи 2–5 раз в неделю в течение трех месяцев. Иногда применяют при меланоме III стадии, но не все врачи и исследователи считают, что стоит практиковать такой метод лечения.
Наши врачи вам помогут
Оставьте свой номер телефона
Таргетная терапия меланомы
Нормальная клетка становится опухолевой, когда в ее генах возникают определенные мутации, и начинают вырабатываться белки, способствующие ее бесконтрольному размножению. Некоторые молекулы, которые «виноваты» в развитии и прогрессировании опухоли, можно заблокировать. На этом основано действие таргетных препаратов.

Таргетная терапия меланомы с мутацией в гене BRAF
Мутация гена BRAF имеется примерно в половине меланом. При этом образуется одноименный неправильный белок, который активирует размножение опухолевых клеток. У таких пациентов применяют две группы таргетных препаратов:
- Ингибиторы BRAF: Эти препараты применяют при IV стадии меланомы с метастазами, они помогают продлить жизнь больного. Таргетные препараты могут быть назначены в качестве адъювантной терапии после операции при III стадии меланомы. Ингибиторы BRAF принимают в виде таблеток или капсул 1–2 раза в день.
- Ингибиторы MEK — белка, который работает вместе с белком BRAF. Вместе с ингибиторами BRAF они обеспечивают более выраженный эффект, и есть данные о том, что комбинированная терапия несет меньший риск серьезных побочных эффектов. Ингибиторы MEK принимают в таблетках 1–2 раза в день.
Таргетная терапия меланомы с мутацией в гене C-KIT
В небольшом количестве меланом выявляется мутация в гене C-KIT. Обычно это меланомы, расположенные на ладонях и подошвах, слизистых оболочках, на областях тела, которые хронически подвергаются воздействию солнечных лучей (шея, лицо). Пациентам с такими опухолями назначают ингибиторы C-KIT.
Химиотерапия меланомы
Химиопрепараты при меланоме применяют нечасто, так как они зачастую оказываются не очень эффективны, опухоль быстро вырабатывает к ним резистентность и начинает снова прогрессировать на фоне лечения.
Насколько эффективно лечение против меланомы? Каков прогноз выживаемости?
В настоящее время удалось добиться следующих показателей пятилетней выживаемости при меланоме:
- I стадия: 92–97%.
- II стадия: 53–81%.
- III стадия: 40–78%.
- IV стадия: 15–20%.
В настоящее время проводятся клинические исследования, ученые ищут новые эффективные методы борьбы с меланомой.
Материал подготовлен заместителем главного врача по лечебной работе клиники «Медицина 24/7», кандидатом медицинских наук Сергеевым Петром Сергеевичем.
Источник
