Мутация braf при меланоме стоимость
Метод определения
полимеразная цепная реакция
Исследуемый материал
фиксированные формалином и залитые парафином блоки тканей со стеклами
Тест используется для определения наличия мутации V600E в гене BRAF для решения вопроса о проведении таргетной терапии.
Белок BRAF относится к семейству киназ RAF и представляет собой цитозольную серин/треонинкиназу. Данная киназа является основным эффекторным белком сигнального пути MAPK, лежащим ниже RAS в системе сигнальных молекул. При активации BRAF фосфорилирует нижестоящие медиаторы, которые участвуют в регуляции пролиферации и выживаемости клеток. Активирующие мутации в гене BRAF ведут к повышению тирозинкиназной активности белка, что обуславливает конститутивную активность сигнального пути MAPK. Мутации в гене BRAF являются одной из наиболее частых событий при различных злокачественных новообразованиях. Наиболее часто данные аберрации встречаются при меланоме кожи, около 50% всех случаев, а также обнаруживаются при раке щитовидной желез (10–70% случаев в зависимости от гистологического типа), при колоректальном раке (~ 10% случаев) и при немелкоклеточном раке легкого (~2%).
Меланома кожи. Частота данных аберраций при поверхностно-распространяющейся меланоме кожи составляет 52-66%, при узловой меланоме- 43-55%; менее часто при меланоме кожи по типу злокачественного лентиго (14-20%) и акрально-лентигинозной меланоме кожи (13-17%). Мутация V600E наблюдается в 90% всех случаев BRAF- положительных меланом. При наличии мутации V600E в гене BRAF в соответствии с RUSSCO рекомендовано проведение комбинированной таргетной терапии тирозинкиназными ингибиторами BRAF/MEK у пациентов с меланомой кожи резектабельной и нерезектабельной III стадии и IV стадий. Мутации в генах BRAF чаще встречаются при меланоме кожи без хронического солнечного воздействия (CSD), чем в опухолях, связанных с CSD: 60% против 6-22%, соответственно.
Колоректальный рак. Мутация V600E в гене BRAF встречается при 5-9% всех случаев колоректального рака (КРР). Наличие данной мутации является причиной резистентности к терапии анти-EGFR антителами у пациентов с метастатическим КРР. При наличии мутации BRAF V600E у пациентов с метастатическим КРР рекомендовано назначение BRAF-ингибитора (RUSSCO 2019). BRAF V600E служит также прогностическим маркером у пациентов с метастатическим КРР.
Немелкоклеточный рак легкого (~2%). Спектр мутаций при НМРЛ значительно отличается от такого при меланоме и колоректальном раке. При НМРЛ мутация V600E встречается реже, чем при других видах опухолей. При аденокарциноме легкого мутация V600E обнаруживается в 50% случаев от всех BRAF мутаций. Мутации в гене BRAF в основном встречаются при аденокарциноме лёгкого и чаще всего ассоциированы с наличием статуса курения. При наличии мутации V600E рекомендовано назначение комбинации BRAF/MEK ингибиторов пациентам с метастатическим НМРЛ (RUSSCO 2019).
Рак щитовидной железы (РЩЖ). Распространенность мутации V600E в гене BRAF при папиллярной карциноме составляет 40-50%, при низкодифференцированной карциноме- 20-40%, при анапластической карциноме 30-40%. Рядом авторов показано, что точечная мутация V600E представляет собой прогностический маркер. Рекомендовано определение мутации V600E в гене BRAF для послеоперационной стратификации риска рецидива с целью решения необходимости проведения лечения радиоактивным йодом (АОР/АЭХ/РОЭ 2020).
Литература
- Dankner, M., Rose, A.A.N., Rajkumar, S. et al. Classifying BRAF alterations in cancer: new rational therapeutic strategies for actionable mutations. Oncogene 37, 3183–3199 (2018). https://doi.org/10.1038/s41388-018-0171-x.
- Федянин М.Ю., Гладков О.А., Гордеев С.С., Рыков И.В., Трякин А.А. и соавт. Практические рекомендации по лекарственному лечению рака ободочной кишки и ректосигмоидного соединения. Злокачественные опухоли : Практические рекомендации RUSSCO #3s2, 2019 (том 9). С. 324–364.
- Строяковский Д.Л., Абрамов М.Е., Демидов Л.В., Новик А.В., Орлова К.В., Проценко С.А и соавт. Практические рекомендации по лекарственному лечению меланомы кожи. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2019 (том 9). С. 243–258.
- Лактионов К.К., Артамонова Е.В., Бредер В.В., Горбунова В.А., Моисеенко Ф.В., Реутова Е.В. и соавт. Практические рекомендации по лекарственному лечению немелкоклеточного рака легкого. Злокачественные опухоли : Практические рекомендации RUSSCO #3s2, 2019 (том 9). С. 32–48.
- Zaman, Aubhishek et al. “Targeting Oncogenic BRAF: Past, Present, and Future.” Cancers vol. 11,8 1197. 16 Aug. 2019, doi:10.3390/cancers11081197.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016;26(1):1‐133. doi:10.1089/thy.2015.0020
- Sanz-Garcia E, Argiles G, Elez E, Tabernero J. BRAF mutant colorectal cancer: prognosis, treatment, and new perspectives. Ann Oncol 2017;28:2648–57. doi:10.1093/annonc/mdx401.
Источник

В норме ген BRAF вместе с факторами роста и гормонами участвует в регуляции деления клеток за счет активации специфического сигнального пути. Если же его структура изменяется, то процесс деления выходит из-под контроля. Мутации в гене BRAF выявляются при различных видах рака, однако на первом месте в списке онкологических заболеваний стоит меланома. Определить статус гена при данной болезни крайне важно, так как от этого будет зависеть дальнейшая тактика лечения.
Частота и виды мутаций BRAF
По данным разных авторов, BRAF мутация встречается от 30% до 70% пациентов, которым поставлен диагноз «меланома». При этом изменения в гене могут быть самыми разнообразными. Всего известно более 40 BRAF мутаций, но наиболее часто (около 90% всех случаев) выявляется замена аминокислоты валина на аминокислоту глутамина в кодоне 600. Соответственно, такая мутация называется BRAF V600E. Второе по популярности изменение в гене при меланоме – это замена аминокислоты валина на аминокислоту аспарагин в том же кодоне. Такая мутация обозначается V600K.
Методы диагностики
Выявить мутации BRAF можно при помощи молекулярно-генетических методов диагностики. Для проведения исследования необходим образец тканей меланомы кожи, в которых содержится не менее 20% опухолевых клеток. Как правило, такой материал поступает в лабораторию после удаления, после чего он фиксируется в формалине и заключается в парафиновые блоки. Перед определением мутаций необходимо выполнить пробоподготовку. Материал извлекается из парафина, затем выполняется процесс экстракции ДНК, которая исследуется.
Базовым методом, который позволяет выявить мутации в гене BRAF, является полимеразная цепная реакция (ПЦР). Это исследование является относительно простым и дешевым, обладает хорошей чувствительностью и специфичностью, однако имеет существенный недостаток. Один анализ позволяет определить только одну мутацию BRAF. Если же стоит задача выявить несколько мутаций, то исследование придется повторять.
Более совершенным считается секвенирование, при помощи которого можно установить точную последовательность ДНК целого гена. Данный метод более затратный и требует дорогостоящего оборудования, но при этом он позволяет одновременно выявить все мутации в гене BRAF за одно исследование. Среди недостатков секвенирования можно отметить риск получить ложноотрицательный результат (выявляется в 2%-10% случаев) из-за присутствия в материале большого количества нормальных клеток с неизмененной ДНК.
Зачем определять BRAF мутацию при меланоме
Определение мутации в гене BRAF имеет важное значение при подборе лечения меланомы. Одним из современных методов является таргетная терапия, которая направлена на устранение конкретного механизма образования опухолевых клеток. В случае с меланомой применяются ингибиторы мутированного фрагмента гена BRAF, которые прерывают цепочку биохимических реакций и не дают опухоли развиваться дальше. При назначении таких препаратов определение статуса гена BRAF должно проводиться в обязательном порядке. При отсутствии мутации дорогостоящее лечение окажется неэффективным, а в некоторых случаях может и ускорить прогрессирование опухолевого процесса.
Препараты из группы ингибиторов BRAF могут применяться только при лечении метастатической меланомы. При этом не изучена эффективность лечения в адъювантном режиме, поэтому такие препараты не назначают пациентам, у которых выполнялось хирургическое удаление опухоли или метастазов, а также химио- и лучевая терапия.
Первыми зарегистрированными препаратами из группы ингибиторов BRAF, которые начали применяться при лечении метастатической и неоперабельной меланомы, стали вемурафениб и дабрафениб. При проведении клинических испытаний, они показали очень хорошие результаты. В настоящее время применяется комбинированное лечение меланомы, при котором, кроме ингибиторов BRAF назначаются ингибиторы МЕК. Такое сочетание позволяет максимально замедлить прогрессирование заболевания и увеличить продолжительность жизни пациентов.
Несмотря на большие успехи в лечении меланомы, все еще остаются нерешенными несколько проблем. Во-первых, отсутствуют эффективные методы терапии, которые можно применять при отсутствии мутаций в гене BRAF. Во-вторых, при назначении ингибиторов BRAF у пациентов спустя некоторое время развивается устойчивость к такому лечению, и меланома начинает снова прогрессировать.
Источник
[12-066]
Определение мутации гена BRAF в тканях опухолей
12015 руб.
Молекулярно-генетическое исследование биоптата опухолевой ткани для определения специфической мутации, которая играет роль в злокачественной трансформации клеток.
Синонимы русские
Генные мутации при меланоме, белок сигнального пути.
Синонимы английские
BRAF Mutation Testing, BRAF Gene Mutation Test, BRAF Gene Mutation Analysis.
Метод исследования
Автоматическое секвенирование.
Какой биоматериал можно использовать для исследования?
Биоптат опухолевой ткани в емкости с фиксирующим раствором или парафиновый блок с биоптатом ткани опухоли. Может использоваться как образец первичной опухоли, так и полученный из метастатического очага.
Как правильно подготовиться к исследованию?
- Специальной подготовки не требуется.
Общая информация об исследовании
Современные успехи в лечении онкологических заболеваний во многом связаны с обнаружением молекулярных механизмов возникновения и развития злокачественных новообразований, отличающих их от клеток нормальных тканей, и появлением лекарственных препаратов, способных воздействовать на них. Такие лекарства называются таргетными, то есть действующими на определенную “цель” в опухолевой клетке. Они обладают хорошим профилем безопасности, так как, в отличие от стандартной химиотерапии, практически не действуют на нормальные ткани и характеризуются большей эффективностью. Однако назначение таргетных препаратов возможно лишь при обнаружении в опухолевых клетках специфической мишени для их действия. Кроме того, обнаружение в опухолевых клетках определенных генетических аномалий может использоваться как прогностический фактор.
Сравнительно часто патологическим механизмом злокачественной трансформации клеток является нарушение в так называемых сигнальных путях. Сигнальный путь представляет собой цепь, по которой активирующий сигнал от рецептора, располагающегося на поверхности клетки, через несколько внутриклеточных белков передается в ядро. Одним из таких сигнальных путей является МАРК (Mitogen-activated proteinkinase). Внеклеточные сигналы (факторы роста, гормоны), связываясь с рецептором, активируют путь МАРК, что в свою очередь приводит к активации в клеточном ядре генов, ответственных за пролиферацию. Каскад сигнального пути МАРК включает в себя белки четырех семейств: RAS, RAF, MEK и ERK. Семейство RAF представлено тремя белками – ARAF, BRAF и CRAF, – наибольшей активностью из них обладает BRAF. В норме сигнальный путь активируется только через связывание рецептора со специфической молекулой. Однако при возникновении точечных мутаций в генах, кодирующих сигнальные белки, они могут приобретать новые свойства. Так, при определенных мутациях гена BRAF этот белок становится способным активировать сигнальный путь независимо от рецептора и запускать процесс неконтролируемого клеточного деления.
Мутации гена BRAF характерны для меланом кожи (по разным данным, от 30 до 70%), колоректального рака, немелкоклеточного рака легкого (около 3%), а также для папиллярного рака щитовидной железы. Наиболее часто выявляется мутация гена BRAF V600E, вторая по частоте V600K, значительно реже встречаются V600D и V600R. Буквы в обозначении данных мутаций означают замену нормальной аминокислоты (валина) в шестисотом положении белка на другую. После открытия роли мутаций гена BRAF в патогенезе опухолей, в том числе меланомы, были разработаны новые препараты – низкомолекулярные ингибиторы мутированного фермента BRAF. Эли лекарственные средства блокируют патологически активированный сигнальный каскад, который запускается мутацией BRAF V600, и тормозят развитие опухоли. К BRAF-ингибиторам относятся вемурафениб (зелбораф) и дабрафениб.
Материалом для исследования служит ДНК опухолевых клеток. Она может быть выделена из биоптата опухоли, находящегося в парафиновом блоке. Если же на исследование предоставлен образец опухоли в емкости с фиксирующим раствором, из него изготавливаются парафиновые блоки для возможности длительного хранения и использования в последующем для других диагностических тестов.
Для чего используется исследование?
- Для определения показаний к назначению низкомолекулярных ингибиторов мутированного фермента BRAF.
Когда назначается исследование?
- Пациентам с неоперабельной или метастатической меланомой (стадии IIIC – IV), а также распространенным немелкоклеточным раком легкого при отсутствии мутации гена EGFR.
Что означают результаты?
Положительный результат – мутация обнаружена. Также указывается вид выявленной мутации.
Отрицательный результат – мутации не обнаружены.
Что может влиять на результат?
Нарушение техники фиксации биопсийного материала, которое может привести к деградации генетического материала и невозможности тестирования.
Важные замечания
- Воздействие BRAF-ингибиторов на опухолевые клетки с отсутствием мутаций в гене данного белка может, наоборот, сопровождаться патологической активацией каскада RAS-RAF-MEK-ERK и провоцировать рост меланомы. Поэтому исключительно важно проводить диагностику мутационного статуса BRAF. BRAF-ингибиторы не должны назначаться в тех случаях, когда мутация не обнаружена или ее статус достоверно неизвестен.
Также рекомендуется
Цитологическое исследование материала, полученного при оперативном вмешательстве
Цитологическое исследование материала, полученного при эндоскопии (бронхоскопия)
Гистологическое исследование биопсийного материала
Гистологическое исследование доброкачественных образований кожи (папилломы, невусы и др.)
Гистологическое исследование биоптата лимфатического узла (1 узел) с использованием рутинных методик окраски
Определение перестройки гена ALK при раке легкого методом ИГХ
Кто назначает исследование?
Онколог, химиотерапевт.
Литература
Henry’s Clinical Diagnosis and Management by Laboratory Methods, 23e by Richard A. McPherson MD MSc (Author), Matthew R. Pincus MD PhD (Author). St. Louis, Missouri : Elsevier, 2016. Pages 1512-1513.
The Basic science of Oncology. Fifth edition. Ian F. Tannock, Robert G. Bristow, Richard P. Hill, Lea Harrington. McGrow-Hill Education, 2013. Pages 173-179.
Программа RUSSCO “Совершенствование молекулярно-генетической диагностики в российской федерации”. Практическое руководство для врачей. www.cancergenome.ru
Доклад “Современные возможности таргетной терапии НМРЛ”, Имянитов Е. Н. Вестник московского онкологического общества, №11 (602), 2013. С. 3-6.
Источник
- Частота и виды мутаций в гене BRAF
- Cтатус мутации гена BRAF и выбор тактики лечения
Частота и виды мутаций в гене BRAF
Частота мутаций в гене BRAF при меланоме кожи, по данным разных исследователей, варьирует от 30-40% до 70%. Наиболее распространенной (69-94% случаев) разновидностью BRAF-мутаций является V600E – замена валина на глутамин в 600-м кодоне. Эта мутация представляется доминирующей, но далеко не единственной разновидностью нарушений BRAF [14, 15]. Второй по частоте является мутация V600К – ее частота может достигать 5-10%. Мутации V600D и V600R встречаются значительно реже.

Cтатус мутации гена BRAF и выбор тактики лечения
За последние годы достигнуты значительные успехи в изучении патогенетических основ развития меланомы и сделан огромный шаг к выявлению новых потенциальных молекулярных мишеней. Открытие молекулярной мишени BRAF и понимание ее роли в патогенезе меланомы легли в основу разработки нового класса препаратов – низкомолекулярных ингибиторов мутированного фермента BRAF. Использование этих препаратов позволяет блокировать патологически активированный сигнальный каскад, который запускается мутацией BRAF V600, и, таким образом, тормозить развитие опухоли. Следует особо отметить, что воздействие данной группы препаратов на опухолевые клетки с нормальной последовательностью BRAF, напротив, может сопровождаться патологической активацией каскада RAS-RAF-MEK-ERK и провоцировать рост меланомы. Этот феномен свидетельствует об исключительной важности достоверной диагностики статуса гена BRAF.
BRAF ингибиторы не должны использоваться в тех случаях, когда статус мутации BRAF не определен или мутация не обнаружена!
Следует подчеркнуть, что ингибиторы BRAF и MEK зарегистрированы к применению только для терапии метастатической формы меланомы. В настоящее время отсутствуют данные по использованию ингибиторов BRAF и MEK в адъювантном режиме, поэтому они не могут быть рекомендованы пациентам, перенесшим (условно-)радикальное удаление первичной меланомы и метастических очагов.
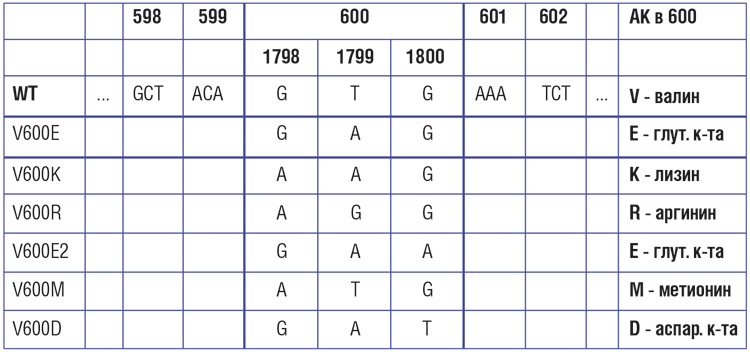
В рандомизированных клинических исследованиях ингибиторы BRAF – вемурафениб и дабрафениб – продемонстрировали значительное преимущество по сравнению со стандартной химиотерапией в отношении частоты объективных ответов, продолжительности жизни без прогрессирования и общей продолжительности жизни у пациентов с метастатической меланомой и подтвержденной мутацией гена BRAF, ранее не получавших системного лечения (см. рис. 2). Полученные результаты привели к пересмотру международных клинических рекомендаций, которые включили эти препараты в современные стандарты лечения метастатической меланомы кожи с BRAF мутацией.
Результаты последних исследований показали, что двойное ингибирование сигнального пути MAРK, которое достигается при одновременном использовании ингибиторов BRAF и MEK, обладает более высокой эффективностью по сравнению с ингибитором BRAF в монорежиме. Важно отметить, что помимо более высокой эффективности комбинация препаратов снижает вероятность развития резистентности к проводимой терапии и отдельных нежелательных явлений, в том числе плоскоклеточного рака кожи. В рамках клинического исследования coBRIM было подтверждено, что комбинированная терапия с использованием препаратов вемурафениб и кобиметиниб в 90% случаев позволяет достичь ответа на терапию у больных BRAF+ метастатической меланомой. У каждого второго пациента более года отсутствовали признаки прогрессирования заболевания, а общая выживаемость приближалась к 2 годам (рис. 3).
Сходные результаты были продемонстрированы в исследованиях дабрафениба и траметиниба. В частности, исследование COMBI-V (дабрафениб+траметиниб vs монотерапия вемурафенибом) продемонстрировало значимой увеличение общей продолжительности жизни у пациентов, получавших комбинированную терапию, по сравнению с применением вемурафениба без ингибитора MEK (25.6 мес. vs 18 мес.; рис. 4, табл. 1). В клиническом испытании COMBI-D сравнивалась эффективность комбинации дабрафениб+траметиниб по отношению к монотерапии дабрафенибом в сочетании с плацебо. Примечательно, что в этом исследовании были зарегистрированы практические идентичные показатели общей продолжительности жизни (25.1 мес. vs 18.7 мес.; рис. 5, табл. 1).
Определение статуса гена BRAF является обязательным компонентом выработки тактики лечения всех пациентов с неоперабельной/метастатической меланомой кожи.
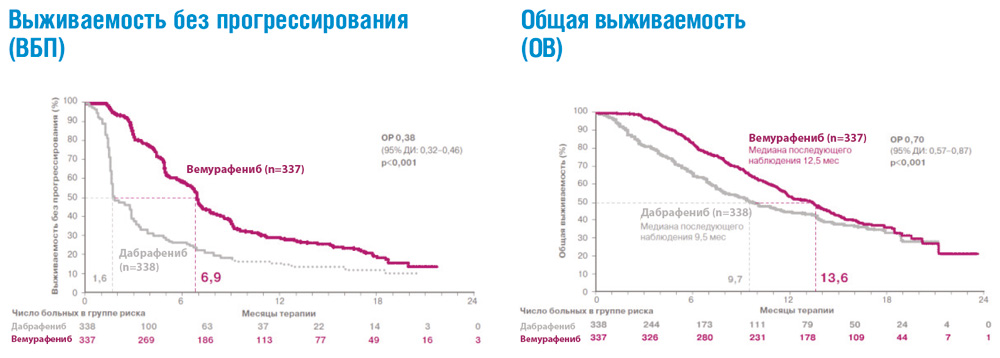
Рисунок 2. Результаты рандомизированного исследования BRIM-3: сравнение эффективности вемурафениба и дабрафениба в 1-й линии терапии метастатической меланомы с мутацией BRAF.
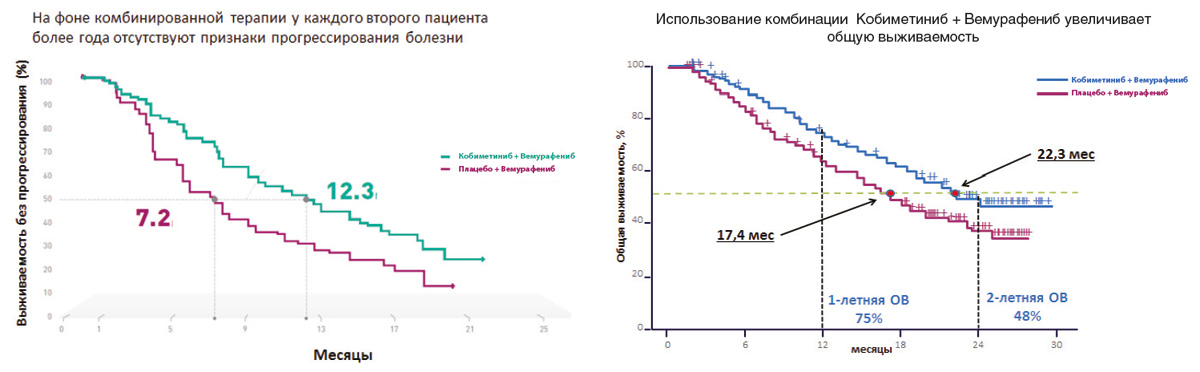
Рисунок 3. Результаты рандомизированного исследования coBRIM: сравнение эффективности комбинации кобиметиниба+вемурафениба и вемурафениба+плацебо в 1-й линии терапии метастатической меланомы с мутацией BRAF.
Рисунок 4. Результаты клинического исследования COMBI-V: (дабрафениб+траметиниб vs монотерапия вемурафенибом).
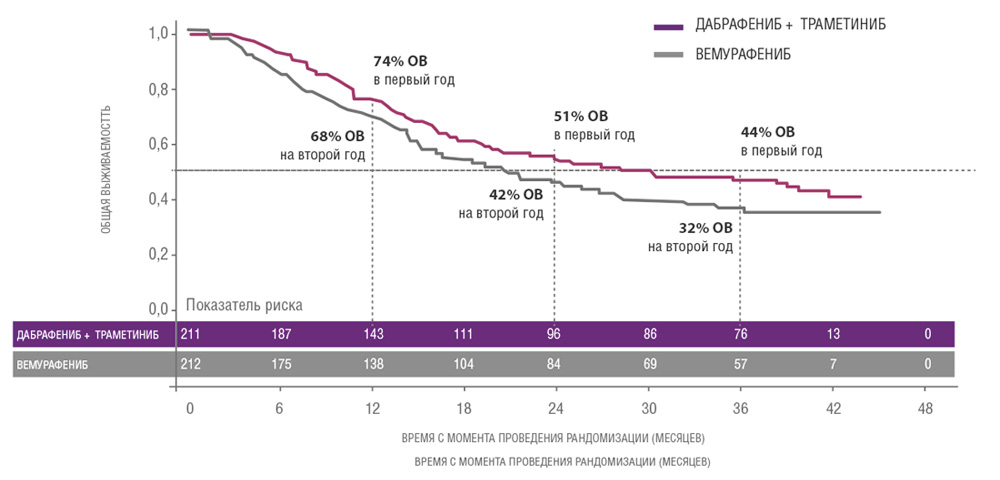
Рисунок 5. Результаты клинического испытания COMBI-D: эффективность комбинации дабрафениб+траметиниб по отношению к монотерапии дабрафенибом в сочетании с плацебо.
Сводные данные по всем исследованиям представлены в таблице 1.
| Исследование | COMBI-d | COMBI-v | ||
|---|---|---|---|---|
| Препарат(ы) | Д + T | Д + пла | Д + T | В |
| Кол-во пациентов, n | 211 | 212 | 352 | 352 |
| Медиана ВБП, мес. | 11,0 | 8,8 | 12,6 | 7,3 |
| Медиана ОВ, мес. | 25,1 | 18,7 | 25,6 | 18,0 |
| Медиана ОВ, ЛДГ≤ВГН | Нет анализа | НД | 21,5 | |
| Медиана ОВ, ЛДГ>ВГН | 10,8 | 8,9 | ||
Сокращения: В – вемурафениб, К – кобиметиниб, Д – дабрафениб, Т- траметиниб, пла – плацебо, НД – не достигнута, ВГН – верхняя граница нормы.
Таким образом, использование BRAF/MEK ингибиторов у пациентов с мМК, имеющей BRAF мутацию, представляет первый успешный пример персонализированной терапии, изменившей представление о мМК как об опухоли, рефрактерной к лекарственному лечению. Эти препараты пришли на смену химиотерапии и стали новым стандартом лечения меланомы с BRAF мутацией, что подтверждает ранее сформулированный постулат о необходимости разработки различных подходов к лечению для различных молекулярно-генетических подтипов меланомы. Появляются результаты исследований таргетных препаратов и при других типах меланомы, имеющих альтернативные мутации (NRAS, cKIT). Можно ожидать, что определение молекулярно-генетического портрета опухоли уже в ближайшее время станет неотъемлимой частью разработки стратегии лечения каждого пациента, имеющего диагноз «меланома».
На сегодняшний день все существующие BRAF и MEK ингибиторы зарегистрированы на территории Российской Федерации и, при соответствующем лекарственном обеспечении, с успехом могут быть использованы для терапии мМК. Профиль безопасности этих препаратов позволяет использовать их в амбулаторных условиях.
Статьи:
- Г.Ю. Харкевич. Вемурафениб в лечении метастазов меланомы в головной мозг. Онкология. Журнал им. П.А. Герцена, 6, 2014.
- Г.А. Франк et al, Первое Всероссийское молекулярно-эпидемиологическое исследование меланомы: результаты анализа мутаций в гене BRAF. Архив Патологии, 3, 2014.
- С.А. Проценко et al, Современные возможности персонализированной терапии метастатической меланомы кожи. Современная онкология №3, том 16, 2014.
- Larkin J et al. Update of progression-free survival and correlative biomarker analysis from coBRIM: Phase 3 study of cobimetinib plus vemurafenib in advanced-BRAFmutated melanoma; Poster presentation at ASCO 2015.
- Robert C, et al. Ann Oncol. 2015; 26 (suppl 6) [abstract 3301].
- Flaherty K, et al. J Clin Oncol. 2016; 34 (suppl; abstr 9502).
- Hauschild A, et al. Poster presented at ESMO 2014, Abstract 1092PD.
- Robert, C. LBA4 Oral presentation at ESMO 2015.
Войти
в базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Регистрация
в программе
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Источник
