Браф мутация при меланоме лечение
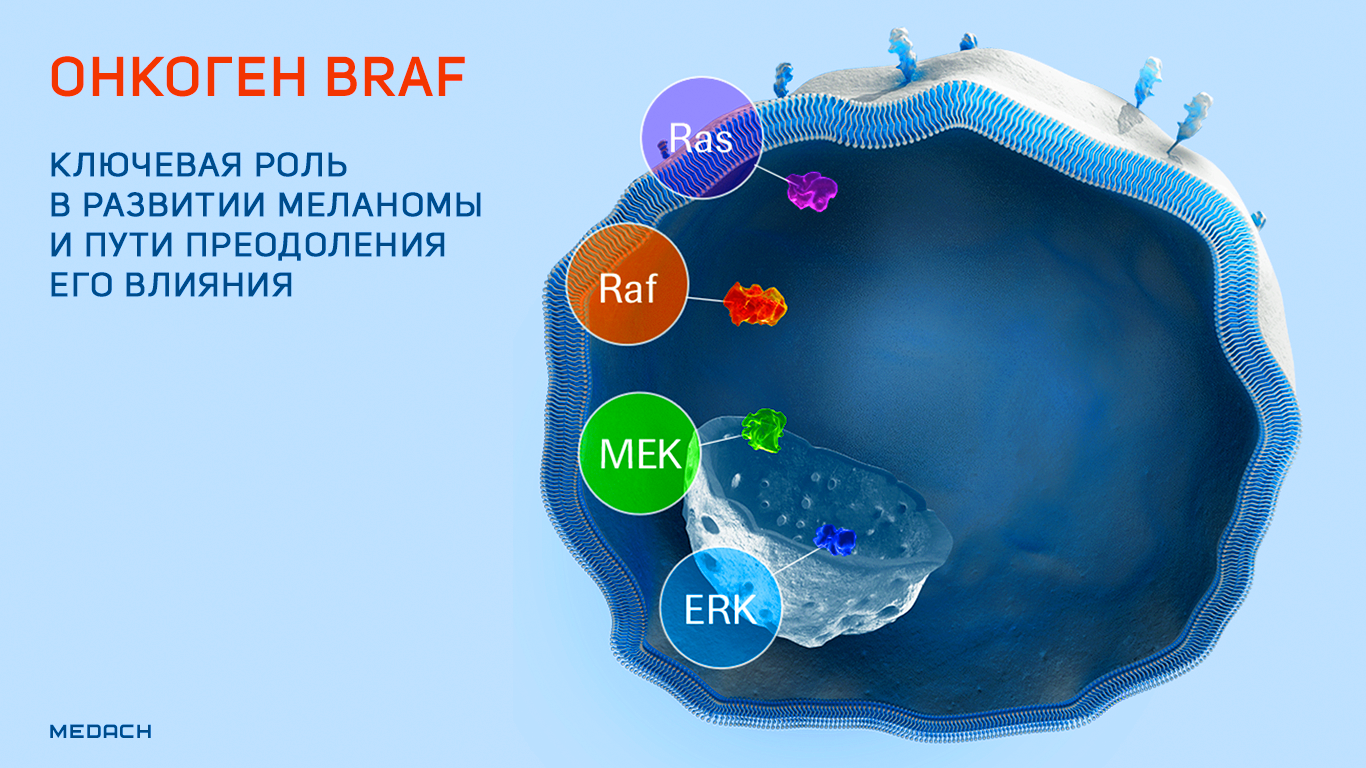

В норме ген BRAF вместе с факторами роста и гормонами участвует в регуляции деления клеток за счет активации специфического сигнального пути. Если же его структура изменяется, то процесс деления выходит из-под контроля. Мутации в гене BRAF выявляются при различных видах рака, однако на первом месте в списке онкологических заболеваний стоит меланома. Определить статус гена при данной болезни крайне важно, так как от этого будет зависеть дальнейшая тактика лечения.
Частота и виды мутаций BRAF
По данным разных авторов, BRAF мутация встречается от 30% до 70% пациентов, которым поставлен диагноз «меланома». При этом изменения в гене могут быть самыми разнообразными. Всего известно более 40 BRAF мутаций, но наиболее часто (около 90% всех случаев) выявляется замена аминокислоты валина на аминокислоту глутамина в кодоне 600. Соответственно, такая мутация называется BRAF V600E. Второе по популярности изменение в гене при меланоме – это замена аминокислоты валина на аминокислоту аспарагин в том же кодоне. Такая мутация обозначается V600K.
Методы диагностики
Выявить мутации BRAF можно при помощи молекулярно-генетических методов диагностики. Для проведения исследования необходим образец тканей меланомы кожи, в которых содержится не менее 20% опухолевых клеток. Как правило, такой материал поступает в лабораторию после удаления, после чего он фиксируется в формалине и заключается в парафиновые блоки. Перед определением мутаций необходимо выполнить пробоподготовку. Материал извлекается из парафина, затем выполняется процесс экстракции ДНК, которая исследуется.
Базовым методом, который позволяет выявить мутации в гене BRAF, является полимеразная цепная реакция (ПЦР). Это исследование является относительно простым и дешевым, обладает хорошей чувствительностью и специфичностью, однако имеет существенный недостаток. Один анализ позволяет определить только одну мутацию BRAF. Если же стоит задача выявить несколько мутаций, то исследование придется повторять.
Более совершенным считается секвенирование, при помощи которого можно установить точную последовательность ДНК целого гена. Данный метод более затратный и требует дорогостоящего оборудования, но при этом он позволяет одновременно выявить все мутации в гене BRAF за одно исследование. Среди недостатков секвенирования можно отметить риск получить ложноотрицательный результат (выявляется в 2%-10% случаев) из-за присутствия в материале большого количества нормальных клеток с неизмененной ДНК.
Зачем определять BRAF мутацию при меланоме
Определение мутации в гене BRAF имеет важное значение при подборе лечения меланомы. Одним из современных методов является таргетная терапия, которая направлена на устранение конкретного механизма образования опухолевых клеток. В случае с меланомой применяются ингибиторы мутированного фрагмента гена BRAF, которые прерывают цепочку биохимических реакций и не дают опухоли развиваться дальше. При назначении таких препаратов определение статуса гена BRAF должно проводиться в обязательном порядке. При отсутствии мутации дорогостоящее лечение окажется неэффективным, а в некоторых случаях может и ускорить прогрессирование опухолевого процесса.
Препараты из группы ингибиторов BRAF могут применяться только при лечении метастатической меланомы. При этом не изучена эффективность лечения в адъювантном режиме, поэтому такие препараты не назначают пациентам, у которых выполнялось хирургическое удаление опухоли или метастазов, а также химио- и лучевая терапия.
Первыми зарегистрированными препаратами из группы ингибиторов BRAF, которые начали применяться при лечении метастатической и неоперабельной меланомы, стали вемурафениб и дабрафениб. При проведении клинических испытаний, они показали очень хорошие результаты. В настоящее время применяется комбинированное лечение меланомы, при котором, кроме ингибиторов BRAF назначаются ингибиторы МЕК. Такое сочетание позволяет максимально замедлить прогрессирование заболевания и увеличить продолжительность жизни пациентов.
Несмотря на большие успехи в лечении меланомы, все еще остаются нерешенными несколько проблем. Во-первых, отсутствуют эффективные методы терапии, которые можно применять при отсутствии мутаций в гене BRAF. Во-вторых, при назначении ингибиторов BRAF у пациентов спустя некоторое время развивается устойчивость к такому лечению, и меланома начинает снова прогрессировать.
Источник

BRAF является достаточно известным онкогеном, а вот приставка V600E после его названия ясна не каждому. Между тем мутация в структуре данного онкогена играет ключевую роль в развитии меланомы — опухоли с одним из самых неблагоприятных прогнозов. В этом материале будут рассмотрены история разработки средств против меланомы с мутацией в гене BRAF и пути преодоления резистентности последнего к современной таргетной терапии.
BRAF представляет собой онкоген, кодирующий белок B-Raf — серин-треонин протеинкиназу, участвующую в функционировании высокоонкогенных сигнальных путей RAS/RAF/MEK/ERK (название одного из перечисленных сигнальных путей и дало имя данному белку и его гену). Продукт BRAF обнаруживается в клетках абсолютно разных типов в неактивном состоянии. Его функциональная активация происходит путем димеризации под действием сигнального пути RAS. Активированный B-Raf фосфорилирует и активирует другие ассоциированные сигнальные пути, и киназный каскад, запускаемый в результате этих процессов, поддерживает выживание клеток и их пролиферацию, одновременно ингибируя дифференцировку [1].
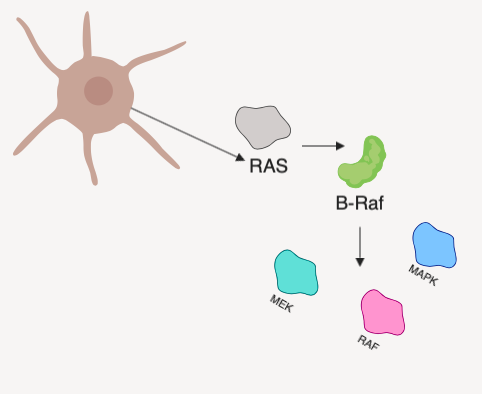
Рисунок 1 | Упрощенная схема активации сигнальных путей, в которых принимает участие протеин B-Raf.
BRAF и его продукт играют критическую роль в формировании опухолей человеческих тканей. Около 7 % всех опухолей связаны с мутацией данного гена, включая 100 % случаев волосатоклеточного лейкоза, 50–60 % случаев меланомы, 30–50 % случаев папиллярной карциномы щитовидной железы, 10–20 % случаев колоректальных опухолей и 3–5 % случаев немелкоклеточного рака легкого. Самой распространенной мутацией является нуклеотидная замена, которая превращает валин в позиции 600 в глутамин (мутация V600E), лизин (мутация V600K) или другую аминокислоту (V600 A/D/G/L и другие). Подобные мутации способствуют тому, что B-Raf перестает зависеть от активации сигнального пути RAS и становится функционально активным в форме мономера [1].
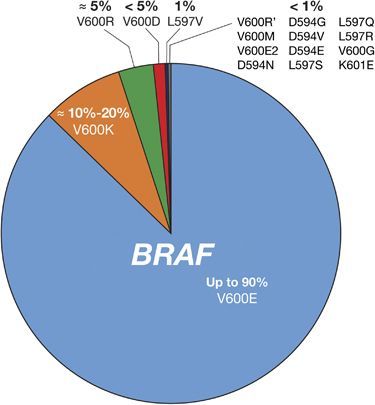
Рисунок 2 | Частота встречаемости наиболее распространенных мутаций BRAF.
Обнаружение активирующих мутаций в данной серин-треонин киназе послужило основой волны последующих исследований того, насколько критическую роль играют ассоциированные с ней сигнальные пути в инициации и прогрессии меланомы и других опухолей. Так, активация ассоциированного с B-Raf сигнального пути МАРК in vivo ассоциируется с пролиферацией клеток меланомы. Доклинические исследования, длившиеся более 15 лет, утвердили, что центральную роль в контроле пролиферации клеток меланомы играет мутация BRAF V600E. Кроме того, данная активирующая мутация оказывает влияние на апоптоз, миграцию, инвазию клеток меланомы, метаболизм глюкозы в них, их адаптацию к гипоксии и ангиогенез формирующейся опухоли. Таким образом, чувствительность опухоли к химиотерапии обретает зависимость не только от функциональной активности B-Raf, но и от скорости протекания в ее клетках процессов, связанных с активацией МАРК [2].
Определение и характеристика мутаций BRAF оказывает существенное влияние на подбор терапии меланомы. Выявление мутаций в структуре этого онкогена осуществляется путем проведения методов генетического секвенирования [3]. Подробнее эти методы рассмотрены в данном материале.
До открытия активирующих мутаций в гене BRAF, меланома крайне тяжело поддавалась терапии. Классическая химиотерапия и пролекарство дакарбазин демонстрировали небольшие терапевтические возможности для клиницистов, стремящихся снизить заболеваемость данным типом опухоли. В 2002 году было обнаружено наличие мутаций BRAF в 60 % случаев меланом, что сыграло огромную роль в определении сущности данного гена в инициации и прогрессировании опухолей кожи. Сегодня известно, что активирующая мутация BRAF обнаруживается в 50 % случаев меланом и в 80 % тканей меланоцитарных невусов. Явная ассоциация данного онкогена с формированием меланоцитарных опухолей дала основу для разработки средств таргетной терапии меланомы, что принесло новую надежду как клиницистам, так и пациентам.
Первый препарат антител, активных против B-Raf, был разработан в 2011 году [4]. Первоначально для таргетной терапии меланомы ингибиторы BRAF (вемурафениб, дабрафениб) использовались как самостоятельные агенты. В дальнейшем была выявлена способность клеток меланомы к формированию резистентности против таких агентов. Одни из наиболее распространенных путей такой фармакорезистентности — это реактивация сигнального пути МАРК, ограничение апоптоза клеток меланомы, а также активация сигнального пути PI3K, стабилизирующего выживаемость меланомных клеток «в обход» МАРК [2, 5].
В настоящее время во избежание формирования терапевтической резистентности при лечении меланомы ингибиторы BRAF комбинируют с ингибиторами другого онкогенного сигнального пути — МЕК (такими препаратами являются биниметиниб и траметиниб). Систематические обзоры и мета-анализы продемонстрировали, что применение подобной комбинации увеличивает общую продолжительность жизни пациентов и замедляет прогрессирование опухоли в сравнении с монотерапией только ингибиторами BRAF [6].
К сожалению, несмотря на обилие современных разработок, меланома по-прежнему ассоциируется с крайне негативным терапевтическим прогнозом и малой общей выживаемостью. Разработки средств таргетной терапии данной опухоли непременно должны продолжаться — возможно, еще одна новая комбинация поможет существенно снизить смертность от этой патологии и сделать диагноз «меланома» менее пугающим.
Источники:
1. The landscape of BRAF transcript and protein variants in human cancer. / Andrea Marranci, Zhijie Jiang, Marianna Vitello [et al]. // Mol Cancer. — 2017. — Vol. 16. — p. 85.
2. Overcoming resistance to BRAF inhibitors. / Imanol Arozarena, Claudia Wellbrock. // Ann Transl Med. — 2017. — Vol. 5, №19. — p. 387.
3. Rapid BRAF mutation tests in patients with advanced melanoma: comparison of immunohistochemistry, droplet digital PCR, and the Idylla mutation platform. / Cornelis Bisschop, Arja ter Elst, Lisette J. Bosman [et al]. // Melanoma Res. — 2018. — Vol. 28, №2. — p. 96-104.
4. BRAF V600E-specific antibody: a review. / Ritterhouse LL, Barletta JA. // Semin Diagn Pathol. — 2015. — Vol. 32, №5. — p. 400-408.
5. BRAF-mutant melanoma: treatment approaches, resistance mechanisms, and diagnostic strategies. / Francesco Spagnolo, Paola Ghiorzo, Laura Orgiano [et al]. // Onco Targets Ther. — 2015. — Vol. 8. — p. 157-168.
6. Combination therapy of BRAF inhibitors for advanced melanoma with BRAF V600 mutation: a systematic review and meta-analysis. / Kim S, Kim HT, Suh HS. // J Dermatol Treat. — 2018. — Vol. 29, №3. — p. 314-321.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Результаты лечения пациентов с меланомой IV стадии неудовлетворительны: медиана выживаемости составляет 6-10 месяцев, 5-летняя выживаемость – менее 10% пациентов.
Факторы, имеющие существенное прогностическое значение у пациентов с меланомой IV стадии – физическая форма и расположение метастатических очагов. Если пациент подходит для хирургического лечения или системного лечения IV стадии, заболевание следует оценивать с помощью визуализации или ПЭТ-КТ (только отдельные метастатические очаги, пригодные для резекции).
В случае вторичных изменений кожи, мягких тканей, лимфатических узлов (лучший прогноз) всегда следует учитывать возможность удаления, то же самое следует делать для изолированных метастазов в паренхиматозные органы.
В случае изменений, которые невозможно удалить, выбор лечения зависит от наличия метастазов в центральной нервной системе, для выявления которых необходимо сначала рассмотреть (решение зависит от места и количества изменений) использование хирургического лечения или облучения центральной нервной системы для отсрочки начала кровотечения или неврологических расстройств.
В паллиативном лечении у пациентов с метастазами в мягких тканях (язва и боль) и костях (боль) также используется лучевая терапия.
Прогресс в развитии генерализованной меланомы с низкой эффективностью классических цитотоксических лекарственных средств связан с неспецифической иммунотерапией с использованием моноклональных антител против CTLA4, которые ингибируют системные механизмы иммуносупрессии, чтобы индуцировать противоопухолевый ответ (активация Т-клеток) и молекулярно направленное лечение ингибиторами серин-трин-киназы.
Дакарбазин
Дакарбазин
Дакарбазин является единственным цитотоксическим препаратом с ограниченной эффективностью (объективный ответ – 15% пациентов, средняя продолжительность ответа – 4 месяца), зарегистрированным для применения при генерализованной меланоме. Режим применения дакарбазина, основанный на регистрационных показаниях, заключается в приеме препарата в течение 5 дней подряд в суточной дозе 200 мг / м 2.
В исследовании III фазы аналогичные результаты были получены с темозоломидом. Паклитаксел отдельно или в комбинации с карбоплатином существенно не увеличивает продолжительность реакции второй линии, и этот препарат еще не одобрен для лечения прогрессирующей меланомы.
В рандомизированных исследованиях не было подтверждено большей эффективности схем лечения несколькими лекарственными средствами, включающими дакарбазин в сочетании с цисплатином, алкалоидами барвинка (например, винбластином) и производными нитрозомочевины (например, кармустином) и тамоксифеном.
Использование биохимиотерапии (химиотерапия вместе с интерлейкином-2 и интерфероном α-2b) не улучшает выживаемость пациентов по отношению к химиотерапии.
Ипилимумаб
Ипилимумаб был одобрен в Европе для лечения пациентов с метастатической меланомой после неудачной предыдущей терапии и показал – по сравнению с пептидной вакциной gp100 – значительное продление общей выживаемости (разница – около 3,5 месяцев) без значительного влияния на выживаемость без прогрессирования заболевания.
Кинетика и продолжительность реакции на ипилимумаб отличаются от классической химиотерапии – пациенты получают пользу от лечения только через 3-4 месяца, что ограничивает его применение больным с прогрессирующей меланомой.
Из-за позднего появления объективных ответов, через 12 недель после начала лечения должна проводиться обязательная оценка эффективности ипилимумаба, особенно с учетом возможности раннего парадоксального прогрессирования, связанного с инфильтрацией иммунологически активных клеток. Для оценки ответа на ипилимумаб целесообразно использовать критерии иммунного ответа.
Процент объективных ответов на лечение ипилимумабом невелик (около 10% пациентов), ограниченное число пациентов имеет долгосрочные преимущества (20-25%), но они характеризуются значительным продлением выживаемости.
Проблема с терапией ипилимумабом – побочные эффекты, связанные с аутоиммунитетом, которые наблюдались гораздо чаще в регистрационном исследовании, чем у пациентов, получавших вакцину (общие и побочные реакции 3-4 степени – в два и пять раз чаще, соответственно). В настоящее время мы не знаем предикторов ответа на лечение ипилимумабом.
Вемурафениб
Мутации RAS / RAF / MEK / ERK MAP киназы (MAPK) обнаруживаются примерно в 75% случаев меланомы кожи. Доминирующим механизмом, приводящим к гиперактивности пути RAS / RAF / MAPK при меланоме кожи, является мутация гена, кодирующего киназу BRAF, при этом соматические мутации в гене BRAF наблюдаются в 50-70% меланом кожи, возникающих в местах, не подверженных длительному воздействию солнечного света.
Опубликованные в 2011 году результаты III фазы регистрационного исследования с вемурафенибом 1-й линии у пациентов с мутацией BRAFV600 показал ответы на лечение у 48% пациентов, получавших BRAF против 5% пациентов, получавших дакарбазин, а также значительное улучшение выживаемости без прогрессирования заболевания (разница – около 5 месяцев) и общей выживаемости (разница – около 3 месяцев).
Для лечения пациентов с прогрессирующей меланомой BRAF был одобрен препарат Вемурафениб. Хотя у большинства пациентов развивается резистентность к лечению (медиана выживаемости без прогрессирования составляет 6-7 месяцев), результаты исследования фазы II-III показали, что медиана общей выживаемости у пациентов с метастатической меланомой составляет 13-16 месяцев, что важно превышает наблюдаемую ранее выживаемость в этой группе пациентов.
Вемурафениб характеризуется значительной кожной токсичностью (повышенной чувствительностью к ультрафиолетовому излучению), а также приводит к образованию вторичных раков (плоскоклеточный рак или кератома почти у 20% пациентов). Нежелательные реакции нередко требуют снижения дозы вемурафениба.
Вемурафениб
Дабрафениб, траметиниб
В 2012 году была подтверждена терапевтическая эффективность другого ингибитора BRAF – дабрафениба (подтверждено, что он сопоставим с вемурафенибом, но с другим профилем токсичности – включая значительно более низкий риск развития плоскоклеточного рака).
Исследование III фазы также подтвердило эффективность ингибитора MEK траметиниба при лечении пациентов с метастатической меланомой с наличием мутации BRAF. Эффективность ингибиторов MEK также наблюдалась у пациентов с мутациями NRAS.
Перечисленные препараты также оказывают благоприятное действие на пациентов со стабильными и / или бессимптомными метастазами в мозг, что до сих пор было недоступным местом для системной терапии метастатической меланомы.
Поскольку ингибиторы BRAF у пациентов с прогрессирующей меланомой BRAF приводят к быстрому ответу и контролю опухоли у большинства пациентов, с ограниченным временем ответа, связанным с активацией механизмов устойчивости (средняя продолжительность ответа составляет около 6-7 месяцев), эти препараты следует рассматривать для выбора у пациентов с симптомами заболевания и / или большой опухолевой массой.
Точных данных относительно последовательности лечения ипилимумабом и вемурафенибом у пациентов с меланомой с мутацией BRAF нет, хотя активность ингибитора BRAF также сохраняется после лечения ипилимумабом.
У пациентов с меланомой без мутации BRAF ипилимумаб является основным вариантом во второй линии терапии. Ингибиторы тирозинкиназы являются предметом интенсивных исследований в комбинированной терапии (с применением ипилимумаба, ингибиторов MEK, ангиогенеза или пути mTOR). В настоящее время ведутся исследования в отношении других лекарственных средств с неспецифической иммуностимулирующей активностью (например, анти-PD1, анти-PDL1-антитела).
Схемы иммунного лечения у пациентов с неоперабельной меланомой, отдаленными метастазами
Иммунное лечение – первое лечение
- Ниволумаб: 3 мг / кг, внутривенно, каждые 2 недели;
- Ниволумаб + ипилимумаб: ниволумаб 1 мг / кг и ипилимумаб 3 мг / кг, в / в, каждые 3 недели, 4 цикла. Затем ниволумаб 3 мг / кг каждые 2 недели;
- Пембролизумаб: 2 мг / кг, в / в , каждые 3 недели.
Иммунологическое лечение – Первое лечение у пациентов с мутацией BRAF
- Дабрафениб + траметиниб: дабрафениб 150 мг перорально 2 раза в день и траметиниб 2 мг / кг перорально, ежедневно;
- Вемурафениб + кобиметиниб: вемурафениб 960 мг, перорально, 2 раза в день в дни 1-28 и кобиметиниб 60 мг ежедневно, перорально 1-21. Циклы повторяются каждые 28 дней.
Иммунологическое лечение – вторая линия лечения
- Пембролизумаб: 2 мг / кг, IV, каждые 3 недели. Nivolumab: 3 мг / кг, IV, каждые 2 недели;
- Ниволумаб + Ипилимумаб: Ниволумаб 1 мг / кг и Ипилимумаб 3 мг / кг, IV, каждые 3 недели, 4 цикла. Затем ниволумаб 3 мг / кг каждые 2 недели;
- Ипилимумаб: ипилимумаб 3 мг / кг внутривенно. Лечение повторяют каждые 3 недели;
- Интерлейкин: 2 (ИЛ-2): ИЛ-2 22 мкг / кг (360 000 МЕ / кг) в увеличивающихся дозах. Порог толерантности к дозе;
- Иматиниба: иматиниб 400 мг перорально, 2 раза в день.
Иммунное лечение – второй курс лечения у пациентов с мутацией BRAF
- Дабрафениб + траметиниб: дабрафениб 150 мг перорально 2 раза в день с траметинибом 2 мг / день, перорально;
- Вемурафениб + кобиметиниб: вемурафин: 960 мг, перорально, 2 раза в день в дни 1-28 и кобиметиниб 60 мг в день, перорально 1-21. Циклы повторяются каждые 28 дней;
- Вемурафениб: Вемурафениб 960 мг, перорально, 2 раза в день;
- Дабрафениб: Дабрафениб 150 мг перорально 2 раза в день.
Местное лечение меланомы III стадии в случае нерезектабельных поражений, частично резецированных или неоперабельных рецидивов после иссечения – в виде инъекции
- Alimogen laherarepvec (TVEC) – вакцины на основе генетически модифицированных вирусов простого герпеса;
- Вакцина Bacillus Calmette-Guerin (BCG);
- Интерферон альфа-2b;
- Интерлейкин 2 (IL-2).
Лечение транзитных метастазов на конечностях
Изолированная перфузия конечностей и инфузионная химиотерапия (ILP – изолированная перфузия конечностей, ILI – изолированная инфузия конечностей).
Поделиться ссылкой:
Источник
